结合自由能计算(二)
配体–受体结合的驱动力
药物小分子进入体内,到达特定的部位,与特定的受体产生相互作用,这些受体主要包括:激素、酶、蛋白质和核酸等,使受体产生一定的变化,抑制或激动某种生物学功能,最终达到治疗疾病的目的。这是药物治疗疾病的基本过程。其中最重要的部分是药物分子与受体产生相互作用,这种相互作用可以根据Gibbs自由能来判断其强弱,而配体与受体之间的相互作用主要包括两类,分别是非键相互作用和共价相互作用。经过多年的研究发现,非键相互作用是药物与受体结合的最为普遍的驱动力,主要原因是药物分子通过非键相互作用可以与受体产生可逆的结合,更利于自身的代谢和排泄。而共价相互作用牵涉到化学键的断裂和生长,只能采用量子化学来计算。因此这里的配体-受体相互作用力仅讨论非键相互作用力。
配体和受体相互作用的过程是十分复杂的,药物分子从溶液的状态进入到受体的活性部位,为了得到最佳的能量匹配和几何形状的匹配,二者的构象均会发生一定的变化,同时,溶剂分子也会因为结合的去溶剂化过程而发生重排,这一过程有也伴随着焓和熵的变化。
对于配体-受体之间的相互作用,不仅要满足二者的空间的要求,即配体的大致形状要与受体的活性口袋的形状匹配,以保证达到最佳的结合,还要满足分子间作用力的互相匹配,即二者结合的相应部位正好有某些基团能够产生分子间相互作用。这些分子间相互作用有氢键、静电作用力、疏水作用力和π-π相互作用等。如图1所示,具有氢键形成条件的基团之间会形成较稳定的氢键;带正或负电荷的基团会相互吸引;非极性基团之间会形成疏水相互作用;而芳香环之间的叠加会形成π-π相互作用。
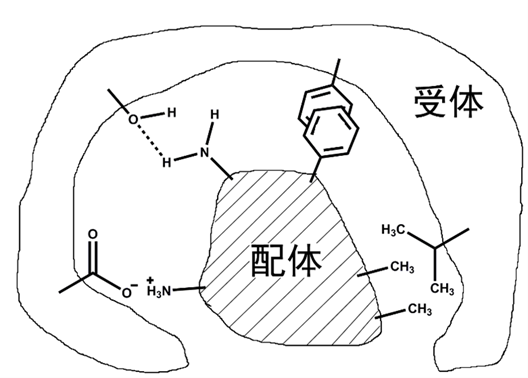
图1 配体与受体之间的非键相互作用
氢键是配体与蛋白质受体结合的重要作用力,也是一种对二者结合贡献最大的一种作用形式。氢键的定义为:氢原子与电负性大的原子X以共价键结合,在与半径小、电负性大的原子Y靠近的过程中,将在X与Y之间以氢原子为媒介,生成一种X-H…Y形式的特殊的分子间作用力,称为氢键。其中X和Y代表F,O,N等电负性较大而原子半径较小的非金属原子,X和Y可以是相同的原子,也可以是不同的原子。氢键具有饱和性和方向性的特征,饱和性是由于氢原子特别小,只能与1个电负性大的原子形成氢键;方向性是由于电偶极矩X-H与Y只有在同一条直线上的时候最强,形成的氢键也最稳定。在氢键X-H…Y中H和Y之间的距离一般小于0.35 nm,X-H…Y构成的夹角一般大于135°,氢键的键能一般为25~40 kJ/mol,结合能是2~8 kcal,因此氢键是一种比范德华力稍强,比共价键弱的作用力。在蛋白质中,许多氨基酸都具有形成氢键的潜力,如丝氨酸、谷氨酸、酪氨酸等,关于不同氨基酸形成氢键能力的强弱,与其在蛋白质内部的空间位置有较大的关系,目前尚未见系统的表述。
另外,疏水相互作用也是蛋白质受体与配体结合的重要作用力之一。疏水作用是非极性分子或基团之间一种较弱的的相互作用,不仅存在于配体和受体蛋白质之间,更是维持大多数蛋白质的结构和性质稳定的关键因素。许多蛋白质的氨基酸之间都可以形成疏水作用,这些氨基酸大都是非极性氨基酸,主要有异亮氨酸、缬氨酸、苯丙氨酸、色氨酸和酪氨酸等。而小分子结构中的芳香环、长链烃基和酯基等属于疏水基团。如果二者在空间位置上靠得很近,则很容易形成疏水相互作用,使二者的结合更加稳定。
在配体和受体结合的过程中,还涉及到溶剂化能的变化,整个结合过程可以看成是一个去溶剂化的过程。如图2所示,在溶液中药物分子的非极性基团在极性溶剂(一般为水溶液)的包围下形成了界面,受体也是如此,并且非极性界面越大,相应的能量也越高。当受体和配体的非极性界面相互靠近时,界面的水溶液会被排开,此时界面变小,能量降低,这就是去溶剂化的过程。去溶剂化过程可以使配体和受体的非极性基团相互靠近,形成能量更低、更稳定的复合物。该过程也包含熵和焓的变化,两个亚甲基之间的去溶剂化可以释放约3 kJ/mol了的能量。去溶剂化的过程促使配体和受体上的非极性基团相互接近,该过程中既包含熵的变化,也有焓的变化。
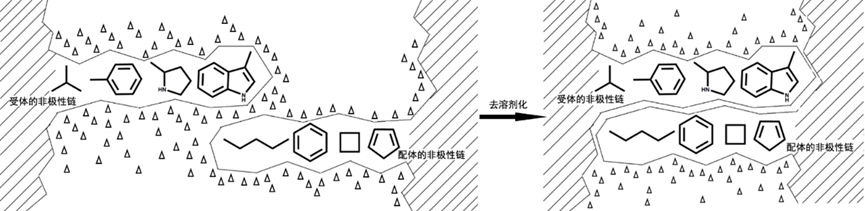
图2 配体与受体相互结合的去溶剂化过程
综上所述,药物分子(配体)与靶点蛋白质(受体)结合的驱动力主要有氢键、疏水作用以及去溶剂化作用等,而不论是氢键和疏水作用的形成,还是去溶剂化过程,均伴随着能量的变化。因此,可以说结合自由能是衡量配体-受体结合强弱以及复合物的稳定性的关键因素之一。而传统的实验方法只能得到结合之后的复合物结果,无法获得结合过程中的能量变化,因此,通过计算机辅助的方法对结合自由能进行计算,是目前为止从微观能量层面研究药物分子与靶点结合的重要手段之一,也是指导药物设计及筛选的重要指导方法。