AIEgen – peptide探针开发新策略
合作单位:Chinese Academy of Medical Sciences
参考文献:Zhang L, Li Y, Mu G, et al. Structure of self-assembled peptide determines the activity of aggregation-induced emission luminogen-peptide conjugate for detecting alkaline phosphatase. Analytical Chemistry, 2022, 94(4): 2236-2243. DOI: https://doi.org/10.1021/acs.analchem.1c04936 (IF=6.7)
背景:
自组装肽纳米材料是由静电相互作用、疏水相互作用、氢键相互作用、π−π堆叠相互作用等非共价相互作用形成的具有一定结构和功能的生物材料。肽基纳米材料因其易于合成和修饰、具有良好的生物相容性和生物活性等优点,在生物医学领域有着重要的应用。近年来的研究表明,自组装肽在组织工程、药物传递、生物成像、疾病诊断和治疗等领域发挥着越来越重要的作用。然而,纳米药物,包括基于肽的纳米药物,在临床转化中遇到了棘手的问题,如体内稳定性,网状内皮系统积累,以及质疑EPR效应。在这种现实背景下,病理微环境中具有原位反应自组装的小分子探针或药物的研究应运而生。随着自组装肽在肿瘤诊断和治疗中的广泛应用,自组装肽已逐渐应用于细菌感染的诊断和治疗以及众多生物靶点的检测。由于催化环境温和,易于实现疾病的诊断和治疗等优点,生物酶催化短肽的原位自组装已被用于靶成像、药物控释以及肿瘤和细菌感染的诊断和治疗。
聚集诱导发光剂(AIEgens),由Tang和同事于2001年首次报道,由于其良好的光稳定性、灵敏度和聚集诱导发光特性,被广泛应用于生物跟踪、检测和成像领域。AIEgens已被用于通过静电相互作用或共价键与多种生物活性分子(如肽和核酸)结合,用于生物传感应用。与传统的荧光分子在组装成纳米结构时容易发生猝灭不同,AIEgens具有在聚集或组装后开启荧光的特性。这种独特的性质使它们成为构建超分子纳米探针的理想发光分子。然而,对于AIEgen共轭的自组装超分子,AIEgen特有的高度扭曲或螺旋桨形状的分子构象往往会阻止AIEgen的正面积累或阻碍分子之间的π−π堆积。Ding等人报道了一种自组装肽GFFY诱导了AIEgens的有序自组装,但产生的纳米纤维与平面结构端序列的纳米纤维完全不同,而且似乎更短。在之前的工作中,该课题组发现AIEgen-peptide的自组装形态不如以萘乙酸为末端的材料。最近已经开发了一些策略来确保AIEgens具有足够的聚集能力进行组装,例如通过非共价键或共价键修饰疏水或两亲分子并将AIEgens整合到预组装的纳米结构中。然而,构建基于AIEgen的高发光效率的超分子体系仍然是一个内在的障碍。
以AIEgen-peptide偶联物为例,通过合理设计肽段结构对偶联物进行优化是可行的,具有良好的可设计性和序列多样性。然而,目前这方面的报道很少。AIEgen -peptide的构效关系有待进一步建立和证明,这对于指导AIEgen -peptide超分子组件的设计至关重要。为了解决上述问题,本文基于同一AIEgen分子(tetraphenylethene, TPE),设计并合成了一系列结构相似的AIEgen肽分子。如图1所示,基于以下考虑设计不同的AIEgen-peptide (TPE-G(x)f(y)pY(z)EEE):(i)通过改变甘氨酸数(G)研究AIEgen与肽之间距离的影响;(ii)通过改变D-苯丙氨酸(f)的数量来调节短肽的自组装能力;(iii)通过改变磷酸化酪氨酸(pY)的数目来调节分子对碱性磷酸酶(ALP)的响应性和分子的疏水性;(iv)将AIEgen -peptide与非AIEgen -end自组装肽共组装以开启其荧光的可行性。这项工作将有助了解AIEgens与多肽的共轭组装过程,为制备高效的AIEgen-peptide偶联物提供帮助,并促进其在酶检测等生物医学领域的应用。
方案设计:
为了深入研究AIEgens与多肽的共轭组装过程,本文采用分子动力学模拟方法对四种多肽分子的自组装过程展开了研究。
主要结果:
分子设计与合成
为了更准确地理解AIEgen-肽偶联物的构效关系,提高AIEgen-肽偶联物的组装和发光性能,根据肽的结构变化合成了一系列TPE-肽偶联物。当探针前驱体分子的磷酸基团被ALP切断时,探针分子的亲水性降低,发生分子间组装。这种积累限制了苯在TPE分子中的旋转,并最终照亮了探针。AIEgen肽的组装和发光是通过改变肽分子的结构来调节的。具体而言,TPE与自组装肽之间的距离通过它们之间的连接子甘氨酸(G)的数量来调节,探针的自组装能力通过d-苯丙氨酸(f)的数量来调节,ALP的响应位点通过酪氨酸磷酸化(pY)引入,响应性和疏水性通过改变磷酸化酪氨酸的数量来调节。还研究了通过与非AIEgen N端的自组装肽共组装来增强TPE-肽的有序组装和发光的可行性。设计的探针采用SPPS法合成,并通过HPLC法纯化。
pY数的影响
在成功合成上述设计的TPE肽后,随后在体外研究了其ALP催化的自组装能力。首先,合成了一系列含有pY的分子,但不幸的是,它们在PBS中的溶解度不好,并且在加入ALP之前存在Tyndall效应和弱荧光。图1A、B以TPE-fffpYEEE(简称1pY)为例进行相关结果展示。这些结果表明,1pY不是一个好的探针分子,因为它的背景荧光,这是由于溶解度差,使其在加入ALP之前以少量聚集体的形式存在于溶液中。随后,通过将第二个pY引入探针(TPE-fffpYpYEEE,缩写为2pY),消除了探针分子本身的背景荧光(图1A,C)。荧光光谱显示,含有两种磷酸化酪氨酸的探针分子在ALP处理前后荧光强度变化较大,表明基于2pY的TPE肽可能是优良的ALP探针。
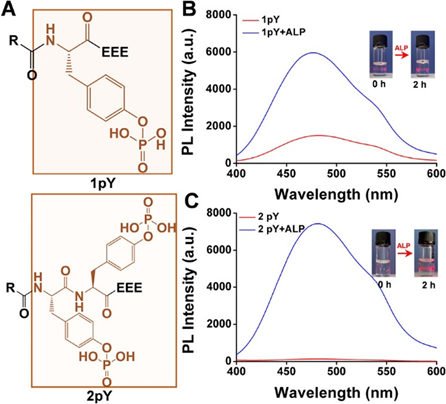
图 1.探针的发光特性
自组装模块的影响
二肽苯丙氨酸-苯丙氨酸(FF)是淀粉样蛋白β42(Aβ42)肽的核心疏水基序,是可以自组装形成类似于Aβ42本身的纳米结构的最短的肽序列。由于FF可以通过氢键和π-π堆叠相互作用来启动肽分子的组装,因此研究人员衍生出大量基于FF的自组装肽。也有报道称,单一苯丙氨酸也可以进行分子自组装。从这个角度来看,通过改变F的数量,试图探索增加共轭肽的组装能力是否可以增强AIEgen肽的整体组装性能和发光能力。通过合成了含有一到四个d-苯丙氨酸(f)的探针,分别是 TPE-fpYpYEEE(缩写为 F1)、TPE-ffpYpYEEE(缩写为 F2)、TPE-fffpYpYEEE(缩写为 F3 或 2pY)和 TPE-ffffpYpYEEE(缩写为 F4)。图2A中不同探针与ALP共孵育后的荧光光谱表明,苯丙氨酸的数量对探针的发光有很大影响。含有一个苯丙氨酸(F1)的探针显示出最低的发光,而在相同摩尔量的探针分子下,F2显示出相对较高的发光。相比之下,含有三个或四个苯丙氨酸的探针在ALP催化后具有最佳的发光性能。同时,还发现F3和F2的CAC值低于F1,表明它们具有更好的自组装能力。这些结果表明,苯丙氨酸的数量越多(从1到4),ALP处理后AIEgen肽的组装效果越好。TEM照片(图2B)进一步验证,处理ALP后,F3和F4自组装,具有均匀的球形形貌,粒径约为10 nm。在ALP处理之前,F1、F2和F3几乎没有荧光信号干扰。然而,F4 在ALP催化之前显示出高背景荧光,这可能是由于苯丙氨酸数量增加导致探针的疏水性增加。因此,使用更发光和非背景荧光的F3探针进行了一些后续实验。
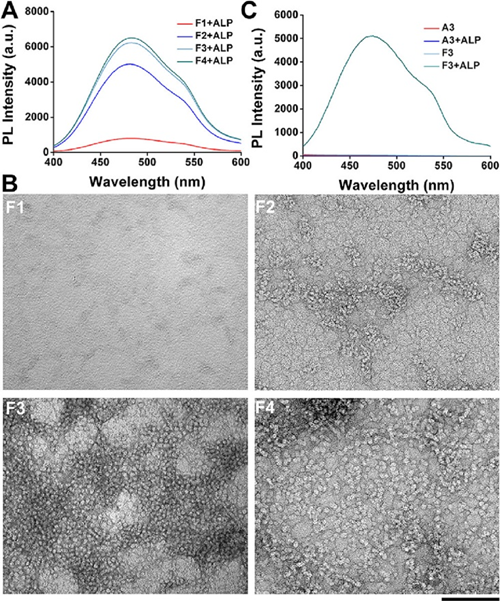
图2.自组装模块对AIEgen-肽偶联物自组装和发光的影响(F)
为了进一步证实苯丙氨酸在促进探针组装和发光方面的贡献,用三个丙氨酸而不是三个苯丙氨酸合成了TPE-aaapYpYEEE(缩写为A3)。图2C显示了A3和F3与ALP共同孵育2小时前后的荧光光谱。很明显,A3在ALP处理后没有发出荧光,也没有形成明显的微形态。这些数据表明,苯丙氨酸基肽的自组装可以诱导共价连接的TPE发光,并且可以通过改变苯丙氨酸的数量直接调控AIEgen肽的发光性能。
F1 和 F3 组装的分子动力学
为了从分子水平上了解TPE-肽探针的组装过程,利用Gromacs对去磷酸化的F1(简称Dp-F1)和去磷酸化的F3(简称Dp-F3)进行了分子动力学模拟。具体而言,构建了一个10 nm×10 nm×10 nm的盒子,并随机填充了6个Dp-F1和Dp-F3分子,形成两个模拟系统。为研究Dp-F1和Dp-F3仿真前后的构象变化,以及自组装的结构紧密性,采用Gromacs聚类模块对两个系统20–50 ns的仿真轨迹进行聚类分析。如图3A所示,Dp-F3自组装成相对紧凑且较大的聚集体,而Dp-F1仅形成只有两个分子的较小聚集体。然后,分析了Dp-F1和Dp-F3组装体的非共价键组成,包括氢键、疏水相互作用以及π–π堆叠相互作用。图3B显示,Dp-F3聚集体中的氢键约为Dp-F1中的2.8倍。如图3C所示,随着仿真的进行,Dp-F1和Dp-F3系统中的疏水相互作用似乎都得到了增强,并在30 ns后趋于稳定,平均值分别为56.8和99.9。这些结果表明,Dp-F3体系内的疏水相互作用明显强于Dp-F1体系内的疏水相互作用。此外,图3D显示Dp-F3 系统的π–π相互作用是Dp-F1系统的1.58倍。图3E,F说明了Dp-F1和Dp-F3系统中可能的π-π相互作用。Dp-F3体系在TPE与苯丙氨酸(Phe)、Phe与Phe之间以及TPE与酪氨酸(Tyr)之间表现出更多的π–π相互作用。总体而言,Dp-F3体系的分子间相互作用比Dp-F1体系的分子间相互作用更强,从而可以形成更稳定的纳米结构。这些结果与图2所示的发光和TEM结果一致。
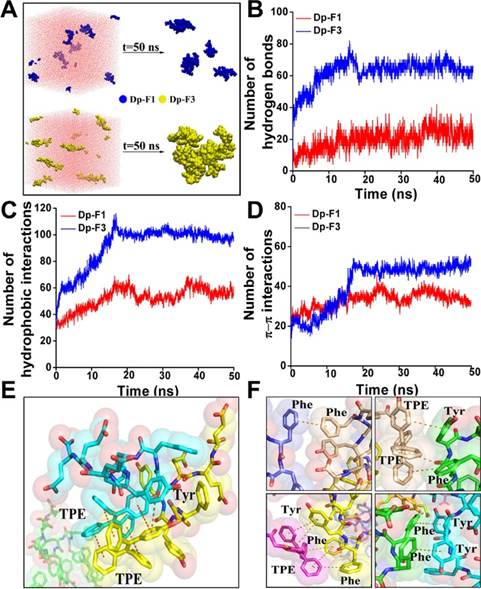
图3.Dp-F1 和 Dp-F3 的分子动力学
AIEgen和多肽之间距离的影响
在基于AIEgen的超分子系统中,AIEgen与超分子之间的连接子的性质,如柔韧性、可旋转性和刚性,对组装体的形成有重要影响。同样,对于自组装肽,N端基团与自组装模块之间的连接体结构,如所含氨基酸的数量,对其自组装能力也有重要影响。因此,认为AIEgen-肽偶联物的接头长度对其发光非常重要。通过改变连接子甘氨酸的数量来调节 TPE 和肽之间的距离。如图 4A-C 所示,当没有甘氨酸或两个甘氨酸时,发光最强,其次是 4 个,然后是 1 个和 3 个,5 个是最弱的。这些结果表明,当AIEgen与组装肽之间的距离大于4个甘氨酸时,AIEgen肽的发光显著降低。图4D中的TEM照片显示,经ALP处理后,G5主要形成分布稀疏且微观形貌不规则的聚集体。当甘氨酸数量少于4时,发光呈现“奇偶效应”。具体来说,当甘氨酸为偶数时,发光最强,当甘氨酸为奇数时,发光较弱。这可能是由于偶数个接头子的奇数和偶数数对分子构型的影响引起的。也有报道称,自组装系统中也存在类似的“奇偶效应”。此外,G4的荧光强度明显强于G3,这表明“奇偶效应”对G3和G4的影响大于距离效应。
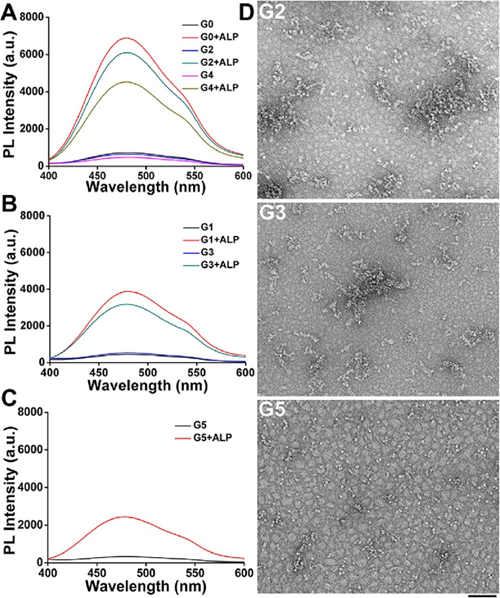
图4.AIEgen与多肽距离对AIEgen-多肽偶联物自组装和发光的影响(G)
G2 和 G5 组装的分子动力学
同样,进行了计算模拟以比较Gromacs对去磷酸化G2(Dp-G2)和去磷酸化G5(Dp-G5)的组装。如图5A所示,聚类分析表明,在模拟过程中,Dp-G5没有形成致密结构,只有两个Dp-G5分子聚集在一起形成复合物。相比之下,Dp-G2在经过50 ns的MD模拟后形成了更稳定、更致密的纳米结构。从图5B–D可以看出,Dp-G2的疏水相互作用和π–π相互作用均显著高于Dp-G5,分别为2.27倍和2.39倍。对它们的进一步构象分析表明,π-π相互作用是Dp-G2分子间组装的重要驱动力之一(图5E,F)。根据上述结果,可以推断,当TPE与肽的自组装模块相对较远(五个甘氨酸以上)时,TPE的分子内运动将受到部分限制或不受限制,AIEgen肽的发光会相应减少或消失。相比之下,在Dp-G2体系中,π–π堆叠相互作用和疏水相互作用在很大程度上抑制了TPE的分子内旋转,并可能产生相对较高的发光。
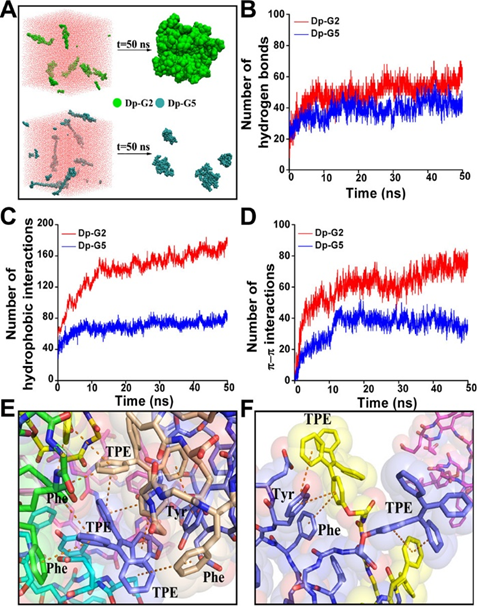
图5.Dp-G2 和 Dp-G5 组装的分子动力学。
结论:
综上所述,为了为开发高效的自组装AIEgen -peptide偶联物和准确理解其结构-组装-活性关系提供有力的途径,开发了一系列基于自组装肽结构变化的AIEgen -peptide探针。研究结果表明,通过增加酶反应位点的数量或探针前体分子的亲水性(pY),适当增加自组装模块中的氨基酸数量(F),保持AIEgen与肽之间的适当距离,以及保持一定的构象(G和奇偶效应),可以增强探针的组装和检测ALP的能力。研究结果表明,与非AIEgen封端的自组装肽的共组装策略是一种简单有效的方法,通过避免复杂的化学合成来增强AIEgen-肽的高效组装和发光。尽管在这项工作中,证明了TPE-肽探针对ALP响应的自组装和发光的精确调控,但这里获得的见解应该适用于构建AIEgen-肽材料用于其他酶的检测、生物标志物成像和疾病治疗。