活细胞核中量子点的原位合成
合作单位:Nankai University
参考文献:Yusi Hu, Zhi-Gang Wang, Haohao Fu, et al., In-situ synthesis of quantum dots in the nucleus of live cells, National Science Review, Volume 11, Issue 3, 2024, nwae021. DOI: https://doi.org/10.1093/nsr/nwae021 (IF=23.178)
背景:
细胞核是真核细胞中最大、最重要的细胞器,是遗传物质储存、复制和转录的主要场所,在细胞代谢、生长、分化、增殖等生命活动中起着核心作用。核膜将核质内的物质与细胞质分离,有选择地控制核内外物质和信息的交换。因此,细胞核内物质的合成通常是有节奏的、有规律的,并根据生理需要受到严格的调节。许多研究报道了细胞核中关键生物物质的合成及其相关机制。然而,纳米颗粒在细胞核内的原位合成尚未见报道,更不用说这种合成的相关调控机制了。
将具有优异光学特性的无机半导体纳米晶体——量子点(QDs)通过原位合成引入活细胞,有望构建超级细胞或智能工程生物系统。该课题组在活的真菌、细菌甚至哺乳动物细胞中,通过适当的时空序列耦合胞内生化反应,系统地开发了量子点和其他纳米材料的合成。2009年,首次在活酵母细胞中实现了人工调节时空耦合的活细胞合成颜色可调CdSe量子点。Na2SeO3和CdCl2生成反应性Se-和cd-前体,并与谷胱甘肽(GSH)及相关酶结合,在活细胞中合成CdSe量子点。基因敲除实验表明GSH代谢途径对CdSe QDs的合成产率很重要,可以通过调控来提高转基因酵母中CdSe QDs的合成产。同时,QDs也可以在金黄色葡萄球菌(S. aureus)细胞中合成,所得荧光细胞可以转化为探针进行病原体检测。最近,在哺乳动物细胞中已经实现了量子点的合成,并方便地用量子点标记微囊泡,实现了设计细胞用细胞内合成的量子点在微囊泡的原位自我标记。因此,如果量子点可以在活细胞(如细胞核)的特定细胞器上合成,就有可能构建智能工程生物系统。
谷胱甘肽具有许多重要的细胞功能,因为它构成了细胞复杂抗氧化网络的中心,缓冲活性氧以促进细胞氧还原信号,并控制细胞生长、发育和防御。谷胱甘肽在细胞内不同区室之间的易位对细胞生命活动的调节至关重要。特别是,GSH在细胞核内的募集和封存对细胞内氧化还原稳态和基因表达有着深远的影响。该研究通过调节GSH的时空耦合策略和代谢途径,实现了核内量子点的原位合成,丰富了荧光纳米晶体的工程生物合成系统,并为细胞核内内源物质的合成机制提供了重要见解,有助于对核内合成功能的新认识。
方案设计:
为了探讨核内量子点合成过程中镉前体的形成,通过模拟各种Cd前体的结合模型,尝试了解决方案RSH是如何参与量子点的生物合成的。
主要结果:
谷胱甘肽在细胞核内量子点合成中的独特作用
在量子点的活细胞生物合成中,GSH不仅作为还原剂,而且与量子点的合成位置有关。为了证明谷胱甘肽起关键作用,用其他含硫醇的还原剂如半胱氨酸(Cys)和二硫苏糖醇(DTT)处理细胞。结果显示,Cys和DTT对荧光强度的影响很小,这表明GSH在细胞核内QDs的生物合成中起着独特的作用。
为了探索谷胱甘肽在生物合成过程中的作用和消耗,使用了一种谷胱甘肽特异性染料,5-氯甲基二乙酸荧光素(CMFDA)。CMFDA染色的MDCK细胞图像显示,谷胱甘肽是细胞中普遍存在的还原蛋白,主要积聚在细胞核中(图1a)。CMDFA荧光定量显示,细胞核中的谷胱甘肽浓度比细胞质中的高约1.5倍(图1b)。Na2SeO3处理后,整个细胞的CMFDA荧光显著下降了80%,表明GSH在硒化过程中被大量消耗,这通过对细胞总GSH的定量进一步证实。这些结果表明,GSH作为生成Se前体的还原剂参与QDs的生物合成,由于GSH分布不均匀,硒化主要发生在细胞核中。随着GSH的加入,CMFDA的荧光强度在整个细胞中显著增加,特别是在细胞核中,这表明GSH的补充补偿了硒化过程中消耗的GSH,并诱导了补充GSH在细胞核中的富集。
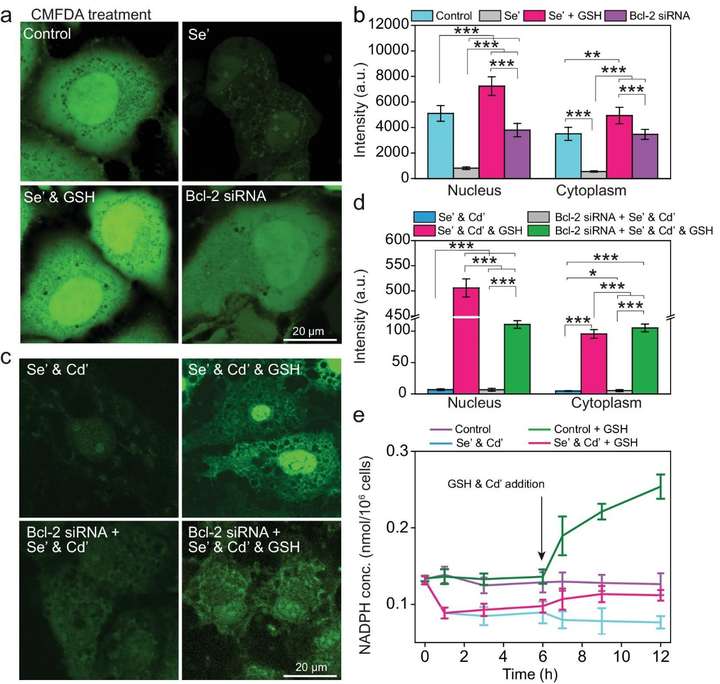
图1 谷胱甘肽在细胞核内量子点的合成中起着独特的作用
此外,有报道称Bcl-2作为谷胱甘肽转运蛋白,可协助谷胱甘肽从细胞质转运至细胞核。为了验证这一观点,用Bcl-2靶向小干扰RNA (siRNA)预处理MDCK细胞,有效抑制Bcl-2的表达。CMFDA对Bcl-2敲低细胞的处理显示出类似的荧光在细胞内的分布,表明Bcl-2负责将GSH从细胞质转运到细胞核,并且是这种不均匀分布的主要原因(图1a, b)。与此一致,Bcl-2敲低细胞的细胞核和细胞质中生物合成的量子点的荧光强度几乎相等(图1c,d)。当用GSH处理Bcl-2敲低细胞时,细胞核中的荧光强度也接近细胞质中的荧光强度,比野生型细胞细胞核中的荧光强度低∼80%(图1c,d)。综上所述,这些结果表明Bcl-2负责将GSH转运到细胞核中形成GSH池,参与细胞核内的硒化反应,实现量子点的原位合成。
细胞核内量子点合成过程中谷胱甘肽还原酶的富集
量子点的生物合成包括两个阶段:细胞硒化和Cd2+结合结晶。亚硒酸盐通常被认为被谷胱甘肽还原为硒二谷胱甘肽(GSSeSG),并被谷胱甘肽相关酶如谷胱甘肽还原酶(GR)和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)进一步还原为低价硒(如GSSeH和HSe-)。高效液相色谱-电感耦合等离子体质谱(HPLC-ICP-MS)分析证实,该方法可以产生低价硒化合物,包括硒半胱氨酸(SeCys)和硒代蛋氨酸(Se- MC)。接下来,确定了与量子点生物合成相关的关键生物分子。
免疫荧光染色检测硒化过程中谷胱甘肽从谷胱甘肽二硫(GSSG)中回收谷胱甘肽时细胞内GR的空间分布。在硒化过程中,GR在细胞核中逐渐富集,在3h后可以清晰地观察到(图2a, b)。此外,蛋白质印迹数据显示,在硒化6h后,细胞总GR含量略有增加,但细胞核中GR含量明显增加(图2c, d)。这些结果表明,在硒化过程中,GR富集主要是由于GR从细胞质转运到细胞核中。GSH处理后,GR在全细胞内表达显著上调,并在细胞核内进一步富集,说明GR在细胞核QD生物合成中的重要性(图4c、d)。最后,研究了GR表达是否影响细胞核中量子点的形成。当用siRNA抑制GR表达时,细胞核和细胞质中的荧光强度显著降低。添加GSH仅能轻微恢复全细胞的GQ荧光。使用CRISPR-Cas9技术敲除GR的MDCK细胞也获得了类似的结果,这表明GR在很大程度上参与了QDs的形成。
鉴于NADPH是GR催化GSSG还原为GSH的电子供体,研究了量子点生物合成过程中NADPH的消耗。NADPH定量结果显示,Na2SeO3的加入使NADPH浓度急剧下降,表明NADPH参与了硒化过程。随着GSH和Cd2+的加入,Na2SeO3处理的细胞中NADPH浓度略有升高,而正常细胞中NADPH浓度明显升高,这表明GSH的加入可能上调了细胞内NADPH水平,而NADPH在QD生物合成过程中被迅速消耗(图1e)。此外,二苯碘(DPI,一种NADPH合成抑制剂)处理几乎完全阻断了细胞中合成量子点的能力。因此,NADPH可能参与硒的还原,并对量子点的产生至关重要。

图2 QD合成过程中细胞核内GR的富集
核内量子点合成过程中镉前体的形成
在镉前体的形成过程中,许多含巯基或硒醇的生物分子(RSH)可能与Cd2+相互作用,通过Ca2+相关转运蛋白将Cd2+转运到细胞内,促进Cd2+的固存。RSH浓度随时间的变化表明,GSH的加入显著提高了RSH浓度,表明RSH可能参与了QD的生物合成。添加N-乙基马来酰亚胺(NEM,一种RSH抑制剂)后,QD的生物合成受到严重抑制,进一步证实了这一点。问题是RSH是如何参与量子点的生物合成的。因此,通过模拟各种Cd前体的结合模型,尝试了解决方案。
首先,选择GR (Protein Data Bank ID: 3DK4)作为富半胱氨酸蛋白模型,探索Cd前体生成的分子机制,因为GR主要参与量子点的生物合成(图3a)。首先利用密度泛函理论(DFT)优化游离GSH、半胱氨酸和SeCys与Cd2+的结合模式。Cd2+与这三种分子的结合力相似,但与GSH的结合力相对较强。考虑到多个硫醇和硒醇通常暴露在蛋白质结构中,它们也可能是Cd2+的潜在结合位点(图3b, d, h)。然后,对GR上可能的结合位点的结构进行了优化。GR的两个Cys位点(Cys440、Cys417)的Cd较高2+亲和力比单一半胱氨酸高,表明更多的配体降低了结合能(ΔE结合)并有助于配位化合物的形成。同时,考虑到组氨酸中的咪唑和苏氨酸中的羟基等其他氨基酸基团也可与Cd2+相互作用,比较了Cys-Cd-Cys (Cys440, Cys417)与Cys-Cd-His (Cys90, His82)的结合能,结果表明Cys-Cd-Cys的Ebind (-625.929kcal/mol)远低于Cys-Cd-His (- 472.20 kcal/mol),表明Cd2+与咪唑相比更倾向于与硫醇结合。与此同时,Cys-Cd-CysThr (Cys58, Cys63, Thr339)模型显示出比Cys-Cd-Cys更强的能量(Ebind:−786.52 kcal/mol),这表明Cd2+与苏氨酸羟基的相互作用可以进一步增强RSH对Cd2+的固存能力。综上所述,Cd2+在Cys-Cd-Cys-Thr模型中具有最强的结合能(Ebind:−786.52 kcal/mol),而在Cys-Cd模型中具有最弱的结合能(−394.28 kcal/mol),说明配体越多,结合能越低,Cd2+的固存就越强(图3e, h)。
据报道,硒化合物(例如GSSeSG和GSSeH)可被GR、NADPH和GSH代谢为硒化氢(HSe−),但HSe−反应性太强,无法直接识别。通过分子动力学(MD)模拟Cd2+与HSe−相互作用的过程,研究了量子点的成核过程。本文将Cd2+与两个S原子和一个O原子(分别来自Cys58、Cys63和Thr339)配位组成的Cys-Cd-CysThr作为量子点的初始原子核。首先,对O (Thr339)、S (Cys58)和S (Cys63)与Cd2+的距离进行统计分析,结果表明,这些距离在10 ns内保持不变,表明这三个配位原子都可以稳定地与Cd2+结合(图3i)。在这个平衡结构中,HSe−在距离Cd2+ 3.5 Å的距离处加入,可以瞬间与Cd2+配位(<0.1 ns),并在380 ns内保持稳定,伴随着O (Thr339)和Cd2+的分离,表明HSe−对Cd2+具有很强的亲和力(图3i)。基于这种稳定状态,在距离Cd2+ 3.5 Å处添加了另一个HSe−。同样,HSe−与Cd2+快速(<0.1 ns)协调,并保持稳定380 ns。
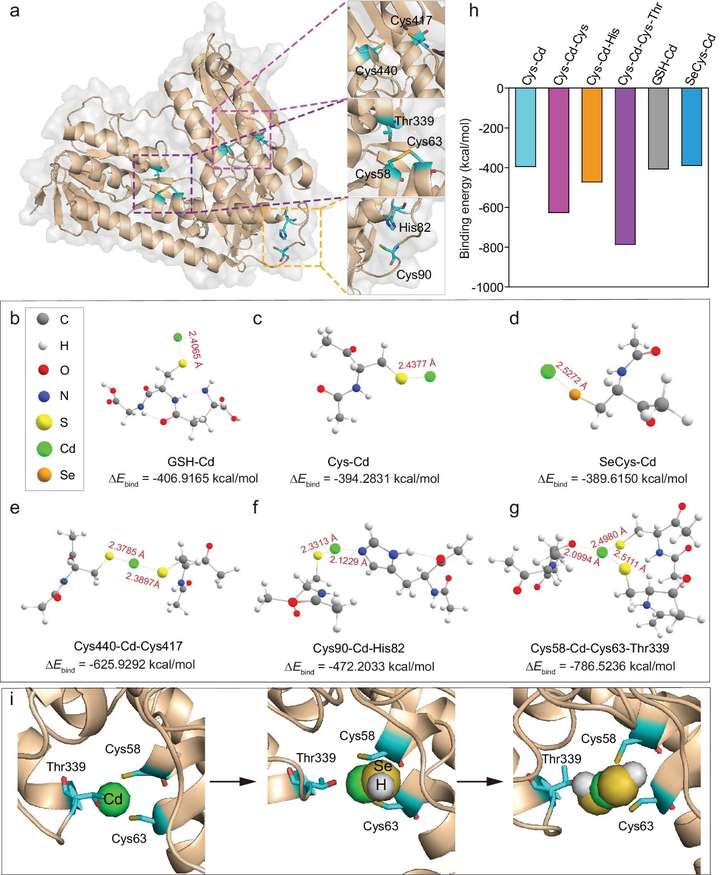
图3 密度泛函理论(DFT)计算和分子动力学(MD)模拟揭示了GR与Cd2+的相互作用以及Cd前驱体的形成
有趣的是,在这个过程中,O (Thr339)再次与Cd2+协调,这表明O (Thr339)与Cd2+之间的协调是由于弱相互作用而随机发生的,当更多的HSe−与Cd2+相互作用时,O (Thr339)可能被稳定的协调所取代(图33i)。在这种模式下,随着Cd2+和HSe−的不断补充,QD逐渐增大,最终形成CdSxSe1−xQD。模拟结果显示,引入Cd2+后,蛋白质的结构框架没有显著变化。
结论:
以往的研究多集中在不同生物体中量子点的合成,而在细胞器水平上靶向合成量子点的研究相对有限。CdSxSe1−x量子点在细胞核内的原位合成证明了细胞系统合成纳米材料的巨大潜力,以及在细胞器中特异性合成量子点的能力,为生物合成领域提供了新的见解。此外,先前的研究表明,不同类型的量子点(如CdS、CdTe和ZnSe)可以在不同的生物体中成功合成。这些研究大多利用谷胱甘肽作为重要的还原剂。这项可行性研究揭示了扩大可在细胞核内合成的量子点类型范围的可能性,并通过监测GSH水平在哺乳动物细胞核中产生这些类型的量子点。因此,该工作为细胞核中外源物质的合成机制提供了关键的见解,有助于对细胞核的合成功能有新的认识。
尽管前景光明,但仍存在一些挑战和问题有待解决。首先,虽然生物合成量子点具有生物相容性,但所需的前体(如Na2SeO3和CdCl2)可能对细胞相对有害。解决量子点的毒性对于将该方法的应用扩展到细胞内应用至关重要,而合成不含有毒金属的功能性纳米材料将非常有价值。其次,该文提出的机制只实现了量子点在细胞核内的合成,缺乏在其他细胞器中原位合成量子点的尝试。因此,在其他细胞器中开发特异性原位合成量子点的方法仍然是必要的。最后,生物合成的量子点亮度低于化学合成的量子点。通过结构改进或探索核壳合金量子点的合成来提高量子点的量子产率可能是提高其亮度的关键。综上所述,这些发现为细胞内定向合成提供了一个潜在的途径,人工实现了在细胞核中非正常发生的过程。这促进了对人工调控活细胞合成量子点的理解和发展,持续的进展自然会在未来带来重大而有意义的发现和应用。