免疫检查点阻断治疗——动态标记精氨酸纳米组装
合作单位:Tongji University
参考文献:J Zang, YS Yang, Y Yang et al. Dynamic tagging to drive arginine nano-assembly to metabolically potentiate immune checkpoint blockade therapy. Biomaterials, 2023, 292: 121938. doi: 10.1016/j.biomaterials.2022.121938. (IF=12.8)
背景:
免疫检查点阻断(ICB)疗法,如抗程序性死亡1 (aPD-1)和抗程序性死亡配体1 (aPDL1),在治疗肿瘤方面取得了革命性进展。尽管如此,ICB单药治疗的益处有限,在许多癌症患者中临床反应率很低(10% ~ 35%)。为了改善ICB治疗,放疗、化疗、光动力治疗或靶向治疗已被应用于肿瘤致敏。众所周知,ICB治疗的应答率与肿瘤微环境(tumor microenvironment, TME)中T细胞的浸润、活化和存活呈正相关。然而,具有高代谢活性的癌细胞可通过大量消耗TME中稀缺的营养物质导致T细胞代谢重编程(功能障碍、应激和凋亡),从而削弱T细胞介导的免疫治疗效果。因此,新的ICB联合策略与T细胞的代谢调节来增强ICB治疗具有很大的前景。
活化的T细胞需要依赖大量的营养物质,包括葡萄糖、氨基酸和脂肪酸,以延长其存活和免疫活性。特别是L-精氨酸(Arg)代谢不仅对支持蛋白质合成至关重要,而且对T细胞的后续分化和激活至关重要。体外精氨酸耗竭显著降低T细胞增殖,抑制免疫应答性干扰素γ (IFN-γ)的产生。相反,补充Arg可促进T细胞恢复增殖、分化和记忆形成,并增加CD4+ T细胞的数量,表明Arg在T细胞正常功能中起核心作用。此外,向T细胞提供精氨酸可以调节活化T细胞的代谢途径,赋予小鼠和人T细胞较高的存活能力,并促进抗肿瘤活性。这表明靶向Arg代谢是维持激活T细胞对抗肿瘤的有效手段。基于合成生物学,Geiger的团队开发了一种工程化的大肠杆菌,可以连续将氨转化为Arg,从而增加肿瘤浸润的T细胞。虽然Arg菌与aPDL1具有显著的协同作用,但其安全性和遗传稳定性仍令人担忧。因此,以安全的方式向TME提供精氨酸是促进T细胞介导的ICB治疗反应的关键和有希望的策略。
然而,直接向TME补充Arg仍然遇到瓶颈,例如患者口服大量Arg (150 g/75 Kg患者)不切实际,这限制了Arg代谢治疗的治疗潜力。即使是肿瘤内注射精氨酸,这也是一个不理想的任务,因为高度亲水的药物会遇到快速的向外扩散。因此,TME输送系统的建设是必不可少的。最近有研究提出通过微米级多泡脂质体实现精氨酸的高包封效率和长期缓释。目前开发新的纳米技术来提高精氨酸在TME中的水平,已经遇到了精氨酸高度亲水性的挑战。精氨酸具有极强的水溶性(148.7 g L−1),物理包封效果较差。此外,物理封装的载体Arg容易飘离,导致初始爆发释放,对TME的递送效率较低。因此,利用高负载效率和高递送策略将Arg递送至TME至关重要,使其更具临床应用潜力。
受前体药物纳米组件具有超高载药量的独特优势的启发,在Arg中引入小分子标签诱导自组装是可行的策略。本文筛选出具有醛基的芳香化合物对苯二甲酸乙二醛(Ter)作为动态标记物,通过形成酸敏亚胺键,增加精氨酸的疏水性来修饰精氨酸。通过标记,Arg可以自组装成纳米精氨酸(ArgNP,图1A),能够通过增强的渗透性和保留(EPR)效应和酸触发的Arg释放进入TME,旨在增强基于代谢重编程的ICB治疗。如图1B所示,ArgNPs和aPDL1协同治疗可以增加肿瘤浸润T细胞,减少髓源性抑制细胞(MDSC),增加促炎m1 -巨噬细胞对肿瘤的作用。值得注意的是,这种治疗还可以抑制肺转移并延长小鼠的生存期。通过标记Arg开发ArgNP的策略具有简单、安全、可生物降解和Arg负载效率高的特点,是一种很有前景的模式,可用于临床应用其他氨基酸或抗肿瘤药物。
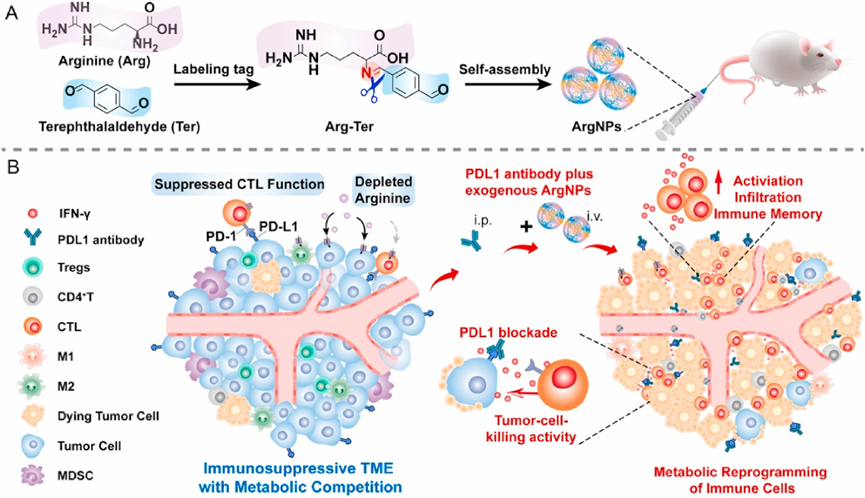
图1 用Ter标记Arg、ArgNPs自组装的形成及其代谢增强免疫治疗的机制示意图
主要结果:
ArgNPs的组装机制
为了了解ArgNPs的组装过程,进行了分子动力学(MD)模拟。将50个Arg-Ter分子放入具有TIP3P水模式的长方体盒子中,并使用GROMACS程序进行200 ns的MD模拟。最初,Arg-Ter分子处于自由随机分散状态。部分分子在20 ns时开始聚集,在200 ns时形成致密的自组装结构(图2A)。为了进一步揭示ArgNPs组装的驱动力,在MD模拟过程中统计分析了ArgNPs中氢键的数量。由于Arg-Ter的分子结构中存在许多氢键供体和受体,氢键相互作用可能是纳米粒子自组装的因素之一。如图4B所示,在50 ns内,Arg-Ter分子间的氢键逐渐增加,然后趋于稳定。平均氢键数为82.77±8.49。此外,Arg-Ter在分子结构上具有芳香环。在模拟的前20 ns,分子间π -π堆积和阳离子-π相互作用逐渐增加,50 ns后趋于稳定,在180 ns左右显著增加(图2C)。阳离子-π和π -π的平均堆叠数分别约为37.13和43.77,进一步增强了ArgNPs的稳定性。MD模拟显示的聚集体结合模式(图2D)进一步表明,氢键相互作用、π -π堆叠和阳离子-π相互作用是ArgNPs组装过程的重要驱动力。
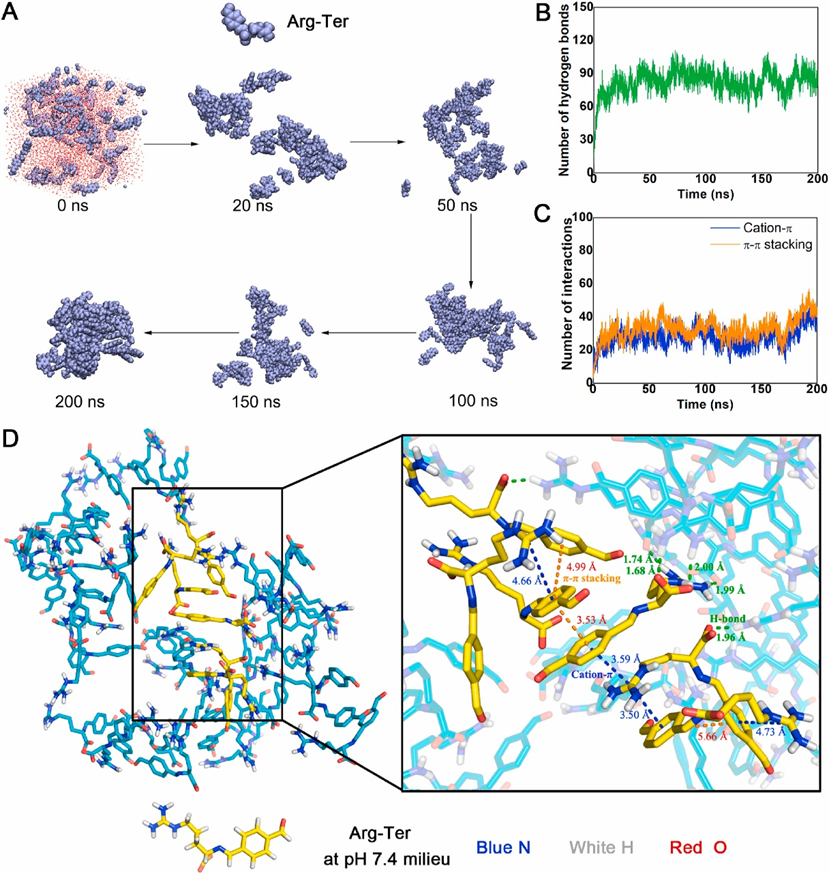
图2 ArgNPs的分子动力学模拟
ArgNPs对体外细胞活力的影响
上述优良的物理特性促使本文进一步研究ArgNPs对免疫细胞和肿瘤细胞的细胞活力。ArgNPs (3.9-125 μg mL−1)对RAW 264.7和4T1的细胞毒性可忽略不计(图3A和B),表明具有良好的生物相容性。为了进一步评估ArgNPs对T细胞活力和存活的影响,制备小鼠脾脏单细胞悬液,并在含IL-2的1640RPMI培养基中进行不同处理孵育(图3C)。钙黄素AM和碘化丙啶(PI)染色检测活细胞和死细胞。与PBS组和Arg组相比,不同剂量的ArgNPs在孵育24 h后对CD3+ T细胞活力几乎没有负面影响(图3D和E),但PBS组CD3+ T细胞死亡数量在第2天显著增加(48 h后,图3F)。引人注目的是,含Arg组的CD3+ T细胞存活比例高于PBS组(图3F和G),表明ArgNPs可以促进T细胞存活。接下来,探讨了ArgNPs是否增强了T细胞杀死肿瘤细胞的能力。用羧基荧光素二乙酸-琥珀酰亚胺酯(CFSE)标记4T1,与PBS、Arg或ArgNPs预处理的脾T细胞孵育24小时,PI染色分析4T1的存活情况。如流式细胞术结果所示(图3H),与PBS组相比,ArgNPs预处理的脾T细胞诱导肿瘤细胞死亡率(4T1)为1.8倍。这些数据表明,ArgNPs可能在T细胞中提供潜在的有利作用,从而有望提高ICB治疗对肿瘤的益处。
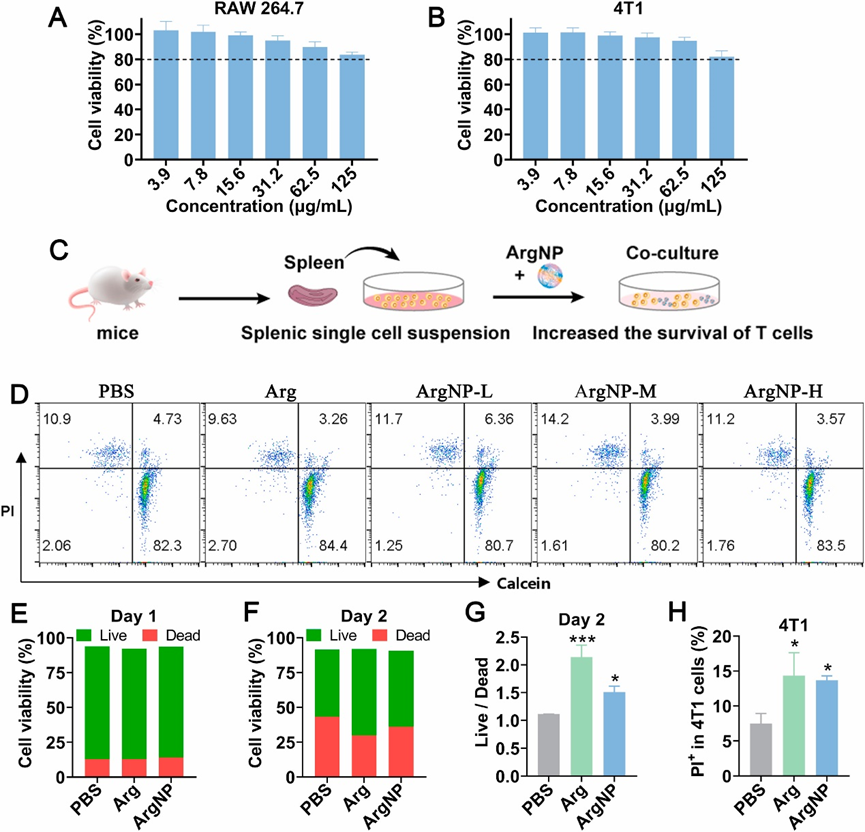
图3 ArgNPs对不同细胞作用的体外评价
体内抗转移性能
乳腺癌是一种致死性疾病,90%以上的癌症死亡率归因于转移,很少通过局部手术或放疗治愈。实验结束时采集各组肺,观察ArgNP + aPDL1联合治疗是否能抑制肿瘤转移。生存率,定义为达到人类终点(肿瘤体积≥1000 mm3),也被用作评估转移引起的死亡率的指标。在实验期间,ArgNP + aPDL1诱导各组小鼠存活率最高(~60%)。用Bouin染色观察肺结节。PBS组可见许多浸润性肺转移灶。aPDL1组、ArgNP组和Arg + aPDL1组肺表面也可见转移性肿瘤结节。正如预期的那样,ArgNP + aPDL1很少出现肺结节(p < 0.05),这与苏木精和伊红(H&E)染色一致,表明ArgNP + aPDL1更有效地抑制肿瘤转移。有趣的是,ArgNP + aPDL1处理后,脾脏中的记忆T细胞(CD3+CD8+CD44+CD62L−)分别比PBS、aPDL1、Arg + aPDL1和ArgNP分别高出2.3倍、2.0倍、1.5倍和2.4倍。此外,ArgNP + aPDL1也导致TDLN中CD44+CD62L−在CD3+CD8+中的比例(40.2%)和CD44+CD62L−在CD3+CD4+中的比例(48.0%)显著升高,表明ArgNP增强了基于aPDL1的免疫治疗的免疫记忆形成。
结论:
综上所述,设计了一种基于动态标记的纳米精氨酸(ArgNP,~104 nm),以高负载效率和酸触发的Arg释放来缓解TME中T细胞的Arg代谢应激。体外实验结果表明,具有生物相容性的ArgNP可提高T细胞的生存能力。进一步联合aPDL1对原位肿瘤和肺转移具有良好的抑制作用。值得注意的是,ArgNP与aPDL1的协同作用极大地促进了ctl和M1-TAM的肿瘤浸润,并减少了免疫抑制的MDSC。此外,这种结合还促进了脾脏和TDLN中记忆T细胞的形成,对肿瘤具有至关重要的意义。结果表明,ArgNP与aPDL1协同作用可达到65%的肿瘤抑制率,延长小鼠生存期(60%生存率),显著增强了aPDL1的益处。此外,本文提出的策略是一种简单、有效和潜在的方法,可用于未来的临床转化,以改变局部TME代谢调节,从而规避当前ICB治疗中临床反应率的问题。