Au-SGTP-sS——肿瘤药物新发现
合作单位:Chinese Academy of Sciences
参考文献:J Shen, J Wang, Q Hao et al. Transformable Nanotheranostics Capable of Sensoring Nucleic Acid Drugs’ Spatiotemporal Behaviors. Advanced Functional Materials, 2023, 33(5): 2209749. doi: 10.1002/adfm.202209749. (IF=18.5)
背景:
核酸药物有望治疗许多与基因相关的难治性和遗传性疾病。与常规药物相比,核酸药物具有更高的特异性、更丰富的靶点选择、更持久的疗效。核酸类药物的天然缺陷,如易被核酸酶降解和难以被靶细胞摄取等,使载体在确定其疗效方面至关重要。此外,患者之间的疾病异质性导致基因治疗效果的不确定性。因此,选择适合患者的核酸药物载体可以激发核酸药物的治疗潜力。构建个性化核酸药物载体,关键是要准确感知药物在给药过程中的时空行为。这可能导致“一刀切”的载体,不能保证将核酸药物有效地递送至任何特定患者的靶细胞,这对一部分恶性疾病患者来说是毁灭性的。因此,筛选适合个体患者的核酸药物载体,对恶性疾病进行个性化治疗具有重要意义。
纳米治疗通过结合药物传递和医学成像激发载体筛选。造影剂掺入载体可用于体内监测核酸药物在各种疾病病灶内的积累。而核酸药物从进入靶细胞到释放到细胞质中的行为变化,对疾病的治疗都是决定性的。然而,这些纳米治疗只能追踪载体的位置。迄今为止,还没有一种纳米治疗技术可以在检测核酸药物行为的同时追踪载体的位置。
在此,本文提出了设计和制备纳米治疗仪以精确感知核酸药物时空行为的四个原则。首先,核酸药物、载体和造影剂应通过共价键结合,使造影剂的信号能够准确监测核酸药物。其次,医学成像和造影剂能够提供高分辨率的三维解剖细节,追踪核酸药物的精确位置。其三,纳米治疗药物的结构随着核酸药物行为的变化而变化,从而通过不同的医学成像信号来感知核酸药物行为的变化。最后,多种信号互不干扰的纳米治疗仪分别通过多模态成像准确感知核酸药物的不同行为。
构建了能够感知核酸药物时空行为的可变形纳米治疗仪。此外,以宫颈癌为例,利用小干扰RNA (small interfering RNA, siRNA)靶向其致病基因Survivin。纳米治疗仪的构建如图1a所示。首先,金纳米颗粒(Au NPs)、Gd-DOTA和DBCO-siRNA通过与功能肽的共价连接进行整合。这些功能肽分别是靶向肽(TP)、sirna偶联肽(SP)和Gd-DOTA偶联肽(GP)。其次,Au NPs和Gd-DOTA分别作为计算机断层扫描(CT)对比和磁共振成像(MRI)对比。CT和MRI都是临床常用的肿瘤诊断手段,能够提供高分辨率的三维解剖细节。这些纳米治疗剂被命名为Au-SGTP-sS。其三,高表达的Furin和谷胱甘肽(GSH)介导了SP和GP在肿瘤细胞质中的水解还原反应,促进了siRNA和MRI探针单体的释放。Au-SGTP-sS随着siRNA行为的改变而转化。MRI探针单体通过顺序缩合反应和π – π相互作用自组装形成超分子聚集体,激活MRI信号。最后,不受干扰的CT和MRI信号分别显示siRNA的积累和释放行为。
Au-SGTP-sS在肿瘤治疗诊断学中的机制如方案1b所示。Au-SGTP-sS通过肠肠注射到荷瘤小鼠体内。在TP的指导下,Au-SGTP-sS在肿瘤中积累,CT监测。然后,Au-SGTP-sS从内体/溶酶体逃逸到细胞质。Furin和GSH同时催化水解SP和GP,从而释放siRNA和MRI探针单体。siRNA 沉默 Survivin 基因以诱导肿瘤细胞凋亡。MRI探针单体原位形成超分子聚集体,激活MRI信号感知siRNA释放行为。
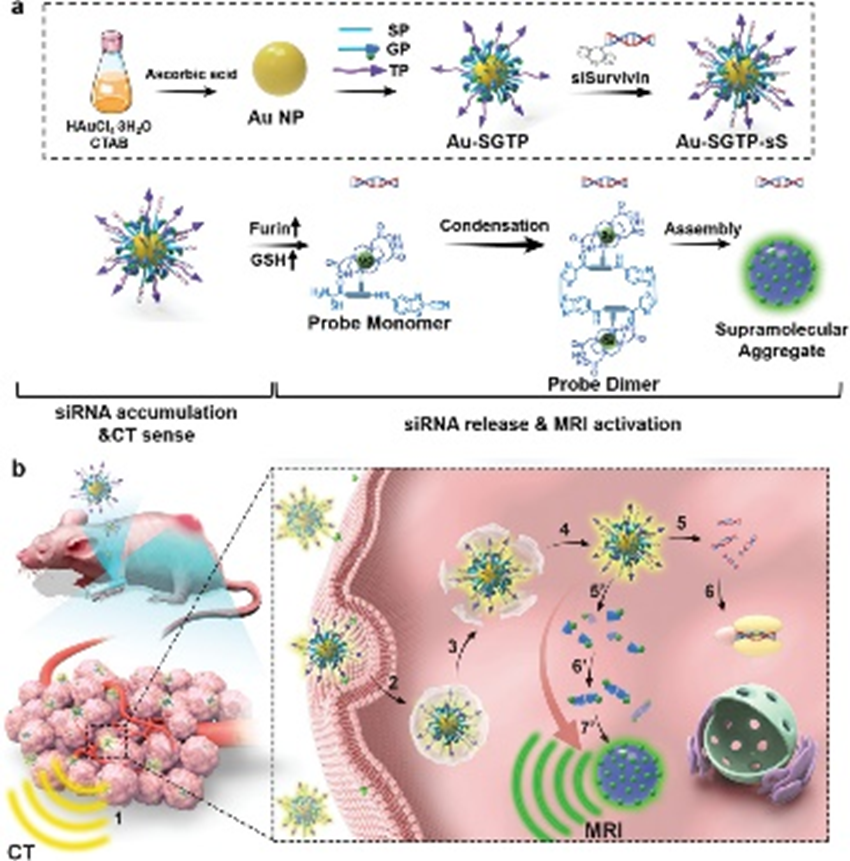
图1 Au-SGTP-sS的制备和肿瘤治疗诊断机制图
方案设计:
为了深入研究两种多肽分子组装结构的差异以及组装的驱动力,本文采用分子动力学(Molecular dynamics, MD)模拟方法对两种多肽分子的自组装过程展开了研究。
主要结果:
Au-SGTP-sS的形成与表征
Au-SGTP-sS为核膜结构。内芯为Au NPs,平均粒径为17.8 nm,采用化学还原法制备。采用固相法合成SP和GP。SP、GP和TP通过Au-S键修饰在Au NPs上,形成外膜。透射电子显微镜(TEM)图像显示肽修饰后的核膜结构明显(图1a)。Au-SGTP的紫外可见光谱发生红移,表明颗粒尺寸增加。此外,DBCO-siRNA通过点击反应与Au-SGTP偶联。弱正电荷(图1b)为Au-SGTP提供了静电吸附siRNA的可能性。然而,与DBCO-siRNA共孵育30分钟后,琼脂糖凝胶电泳显示,即使在高质量比下,DBCO-siRNA条带仍然迁移。因此,排除Au-SGTP对DBCO-siRNA静电吸附的可能性。然后将Au-SGTP与DBCO-siRNA混合,轻轻摇匀过夜。与游离DBCO-siRNA相比,Au-SGTP- DBCO-siRNA偶联的条带向上移位,表明siRNA偶联成功。
探索Au-SGTP与DBCO-siRNA连接的最佳比例。当荧光分子与Au NPs之间的距离≈10 nm时,荧光信号被猝灭。因此,荧光猝灭意味着siRNA在Au-SGTP上偶联。基于这一机制,本文发现Cy5标记的DBCO-siRNA (Cy5-siRNA)的平均荧光强度(MFI)随着Au-SGTP比例的增加而降低。MFI在质量比为30时达到平台值。此外,Au-SGTP-sS的zeta电位在这个比例下是中性的,满足了传递要求(图1b)。因此,在后续的实验中选择这个比例。siRNA偶联后外膜发生变化,水动力直径从57.98±0.73 nm增加到71.17±3.30 nm(图1a,b)。能量色散光谱(EDS)证实,Au元素被GP衍生的Gd元素和siRNA衍生的P元素均匀包围(图1c)。这些结果证明了Au-SGTP-sS的成功合成。Au-SGTP-sS的形态表现出良好的分散性和均匀性,有利于体内给药(图1c)。
Furin和GSH在肿瘤细胞中过表达。它们被用来介导siRNA的特异性释放和Au-SGTP-sS的转化。据报道,SP和GP被furin特异性水解,因此被用作连接siRNA和MRI探针到Au NPs的连接物。Furin孵育1h后,siRNA猝灭的荧光被重新激活,证明Furin介导了siRNA的释放。GSH可以将GP上的二硫键还原为硫醇,从而引发MRI探针的聚集。图1d显示Au-SGTP-sS在加入Furin和GSH后转化。将20 nm大小的核膜结构转化为≈100-200 nm大小的聚集体。这些团聚体中Gd元素含量增加,Au元素含量急剧下降,几乎没有P元素(图1d)。这些结果进一步证明了Furin和GSH介导siRNA的释放和MRI探针的聚集。
含Gd超分子复合体形成机理的分子动力学模拟
Au-SGTP-sS 可以在肿瘤环境中适应Furin和 GSH 后释放 MRI 造影剂。MRI造影剂凝聚形成二聚体,二聚体被重新组装成超分子聚集体(图2a)。采用分子动力学(MD)模拟解释了Au-SGTP-sS适应Furin和GSH后含Gd超分子聚集体的形成机制。通过模拟构象变化和结构的紧密性,可以发现只有少数GP分子聚集在一起,整体仍分散在溶液中(图2b)。这一结果可能是由于GP的柔性结构和与水分子更强的相互作用。相比之下,二聚体的柔韧性较差,刚性的环结构影响了与水分子的相互作用,导致自组装形成稳定的聚集体(图2c)。此外,用溶剂可及表面积(SASA)来评价自组装的程度。
在模拟过程中,二聚体表现出明显的自组装,SASA降低了约50%。相比之下,GP的SASA下降了约14%,表明组装程度较低。GP和二聚体的构象如图2所示。发现GP中的极性基团与周围分子形成了氢键相互作用,苯丙基噻唑环之间没有形成π – π堆叠相互作用。而二聚体的环结构是刚性的,主要是基于分子内的π – π堆叠相互作用,也可以与周围分子的芳环堆叠形成分子间的π – π相互作用。因此,二聚体分子主要通过π – π相互作用保持稳定的层流结构。此外,二聚体结构两端的极性基团也可以与其他分子形成氢键。此外,根据统计分析,二聚体中π – π相互作用的平均次数为10.50±0.76,GP仅为0.48±0.50(图2e)。二聚体的疏水相互作用也比GP强(图2f)。综上所述,这些数据支持探针二聚体中较强的π -π和疏水相互作用有助于细胞内重组。结果,MRI对比的聚集体是超分子。
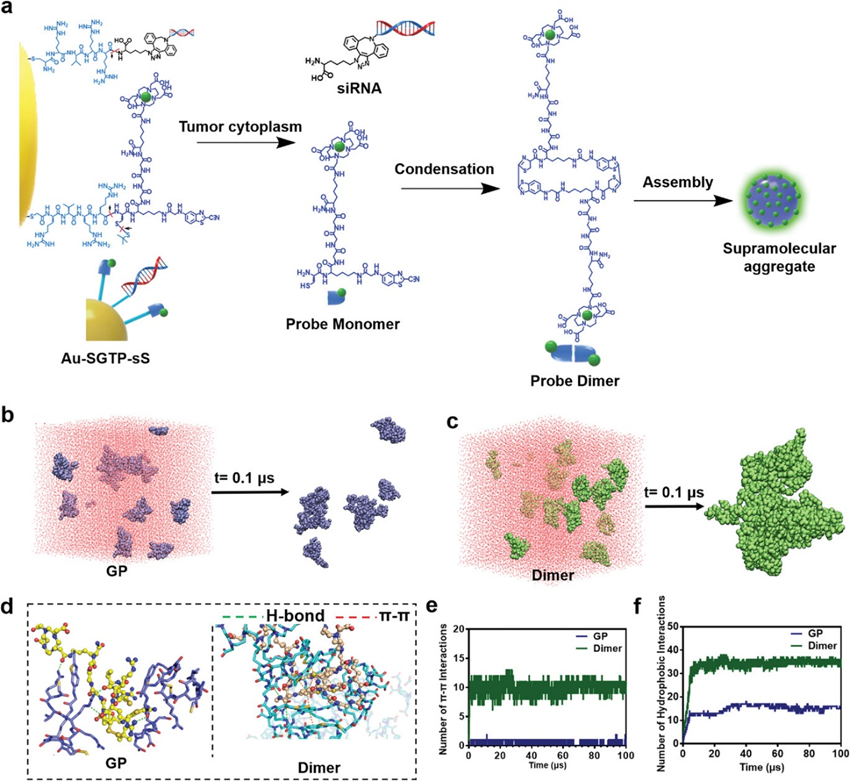
图2 含Gd的超分子聚集体的形成和MD模拟
结论:
在这项研究中,首先构建了具有感知核酸药物时空行为能力的可转换纳米治疗仪,用于个性化肿瘤治疗。根据提出的四个原则设计和制备了纳米治疗剂。载体、对照物和核酸药物通过共价键结合,保证医学成像信号的准确性,命名为Au-SGTP-sS。肿瘤微环境中过表达的Furin和GSH特异性介导siRNA释放和纳米治疗转化。纳米治疗剂的核磁共振造影剂膜结构转化为超分子聚集体,激活核磁共振信号。CT和激活的MRI信号分别以高分辨率感知siRNA在体内的时空积累和释放行为。Au-SGTP-sS显著抑制肿瘤生长,对小鼠无任何副作用。因此,Au-SGTP-sS具有个性化临床肿瘤治疗的潜力。更重要的是,本研究为感知核酸药物时空行为的纳米治疗仪的设计和制备提供了指导。