合作单位:Chinese Academy of Science
参考文献:Z Zhou, YH Pu, W Liu, et al. Assembly and Synthesis Mechanism of CdSe Quantum Dots in Recombinant Escherichia coli Expressing Metallothionein. ACS Sustainable Chemistry & Engineering, 2023, 11(1): 113-121. DOI: 10.1021/acssuschemeng.2c04485 (IF=8.4)
背景:
传统的量子点(QDs)是一类二进制II−VI, III−V和IV−VI及其合金半导体材料,其尺寸限制在纳米尺度(2−10 nm)与普通材料相比。量子点具有量子尺寸效应、表面效应、量子隧道效应和介电畴效应等物理和化学性质因此,量子点已被应用于传感器、光伏电池、光电器件、生物分子和多色标记、生物组织和细胞成像、免疫分析、疾病诊断以及可注射水凝胶的制备等领域。纳米颗粒的制备方法大致可分为物理方法、化学方法、和生物方法。目前,有机相制备方法是应用最广泛、最成熟的制备方法。然而,这些方法必然需要高温高压的反应条件,以及TOPO等危险化学品,限制了量子点在生物成像和免疫学研究中的应用。生物合成量子点因其环境友好性和成本效益而受到广泛关注。细菌真菌、酵母菌、植物和蚯蚓等都有报道能够产生量子点,但生物合成效率普遍较低,因此制备量子点往往需要数天时间。此外,大肠杆菌中CdSxSe1−x量子点的合成可以通过添加葡萄糖来调节,从而促进代谢,增强阳光,诱导酸性环境,并破坏Cd外流途径。
谷胱甘肽(非蛋白硫醇)和金属结合蛋白(蛋白硫醇,包括植物螯合蛋白(PCs)和金属硫蛋白)已被证明对量子点的合成很重要。在QD生物合成过程中,谷胱甘肽作为还原剂和封盖剂,将亚硒酸盐转化为低态硒阴离子。重金属结合蛋白对重金属具有较高的亲和力和产生量子点的能力。另一项研究报告称,生物体内的PC在QDs的形成中起着重要作用。然而,只有很少的研究报道金属硫蛋白用于QDs的合成,主要原因可能是其分子量较低,难以表达和研究。
为了弥补生物量子点合成效率低的不足,该研究基于MT构建了CdSe量子点的体内合成途径,验证了MT对量子点合成的有利作用,并分析了MT介导促进量子点合成的机制。表达金属硫蛋白的重组大肠杆菌比原菌株具有合成优势。采用高分辨率透射电子显微镜(HRTEM)、原位拉曼光谱、分光光度法、x射线衍射(XRD)、x射线光电子能谱(XPS)和一系列荧光方法测定了量子点的光学和结构特征。紫外-可见吸收光谱和ICP-OES测定了生物量子点的产率。采用紫外吸收光谱、蛋白质模拟、分子对接等方法研究金属硫蛋白与Cd2+的结合方式,采用分子动力学模拟方法研究金属硫蛋白量子点的合成途径。
方案设计:
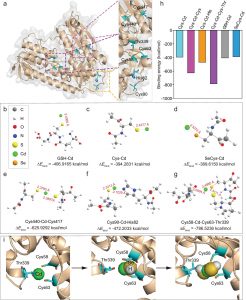
为了研究金属硫蛋白与Cd2+的结合方式。通过与魔德科技技术团队沟通,拟通过分子动力学模拟方法研究了GST-MT蛋白与不同量子点的结构模型。
主要结果:
金属硫蛋白在量子点合成中的作用
通过紫外吸收光谱对GST-MT结合Cd2+的能力进行了验证和探索。先前的研究表明,金属硫蛋白结合的Cd2+越多,Cd离子的电荷转移到巯基上,在特定范围内250nm处的吸光度值越高。当结合接近饱和时,吸光度值保持不变。实验结果表明,随着Cd2+浓度的增加,系统的吸光度值也随之增加(图1a)。当Cd2+浓度为GST-MT浓度的8倍时,体系的吸光度没有增加(图1b),说明GST-MT可以与Cd2+结合,饱和比为8倍。
通过检测不同Cd2+浓度下大肠杆菌的生长曲线发现,随着Cd2+浓度的增加,重组大肠杆菌对生长的抑制作用增强,但重组菌对Cd2+的耐受性较亲本菌强,金属硫蛋白的存在可以促进重组菌的生长。同时,Cd2+对重组大肠杆菌的致死浓度50为1.31 mM。因此,选择1 mM Cd2+作为后续反应的前体浓度,以确保细菌数量足够。
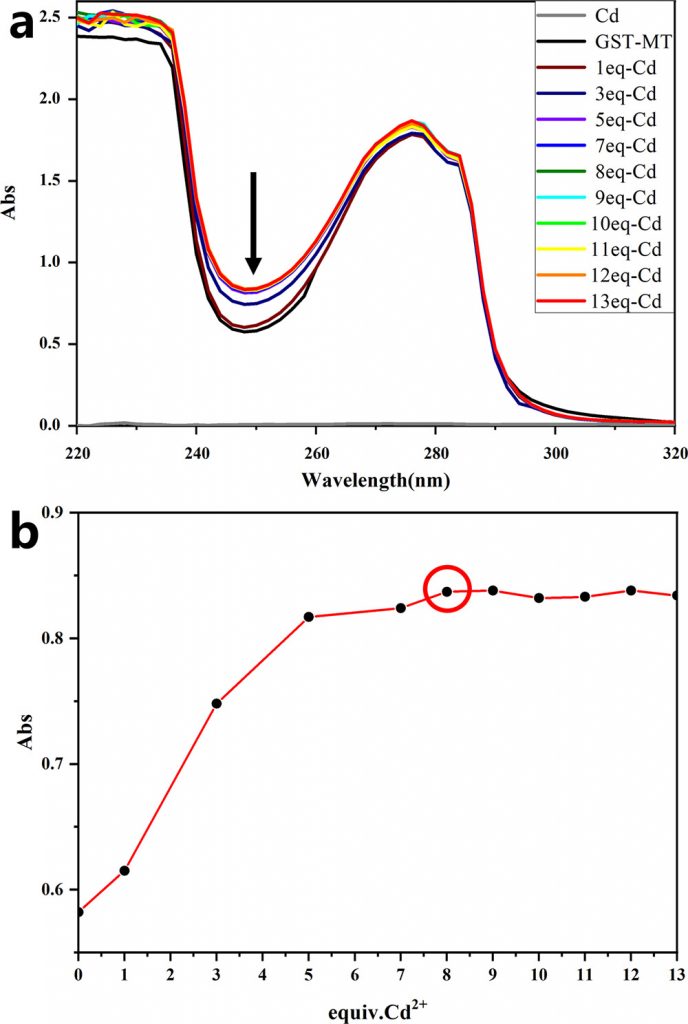
图1 (a) GST-MT在250 nm处与不同倍数Cd2+结合的紫外吸收光谱和(b)吸光度曲线。
GST-MT与量子点的结合机制
以GST-MT为模型蛋白,探讨生物量子点的合成机制。从图2a可以看出,该蛋白主要由GST和MT区域组成。MT结构域是主要结合量子点的区域,该区域的半胱氨酸与Cd2+的协调分布更广。具体来说,Cys237、Cys254和Cys258三个氨基酸在空间结构上相对接近,在量子点上与Cd2+形成了相对稳定的配位。
为了进一步分析量子点与GST-MT蛋白的结合,本研究分析了GST-MT与Cd2+结合及随后生长的五种模式。在没有QD结合的GSTMT体系中,三个氨基酸的结构相对松散(a,图2b)。在Cd2+结合的初始阶段(QD1系统),Cys237、Cys254和Cys258通过S/O与Cd2+形成较强的配合。
Cys-Cd作为量子点合成的初始核。在QD2体系中,由于引入了HSe-基团,空间位阻增加,使得Cd原子只能与一些Cys原子配位。在QD3体系中,大的位阻阻止了配位作用,Cd与HSe−去质子化。在QD4和QD5系统中,中心的Cd原子与Cys原子分离。QDs与GST-MT的组合模型如图2c所示。
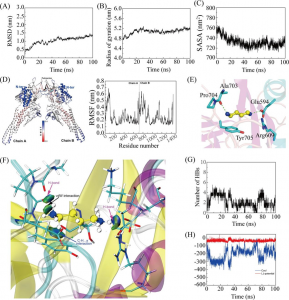
此外,GST-MT、QD1和QD2系统的均方根偏差(RMSD)值在模拟过程中波动较小。然而,随着量子点结构的增加,蛋白质系统的波动也明显增加。QD3-5体系的值在前30 ns波动较大,这可能是因为较大的量子点结构影响了蛋白质的MT区,导致蛋白质整体波动较大。
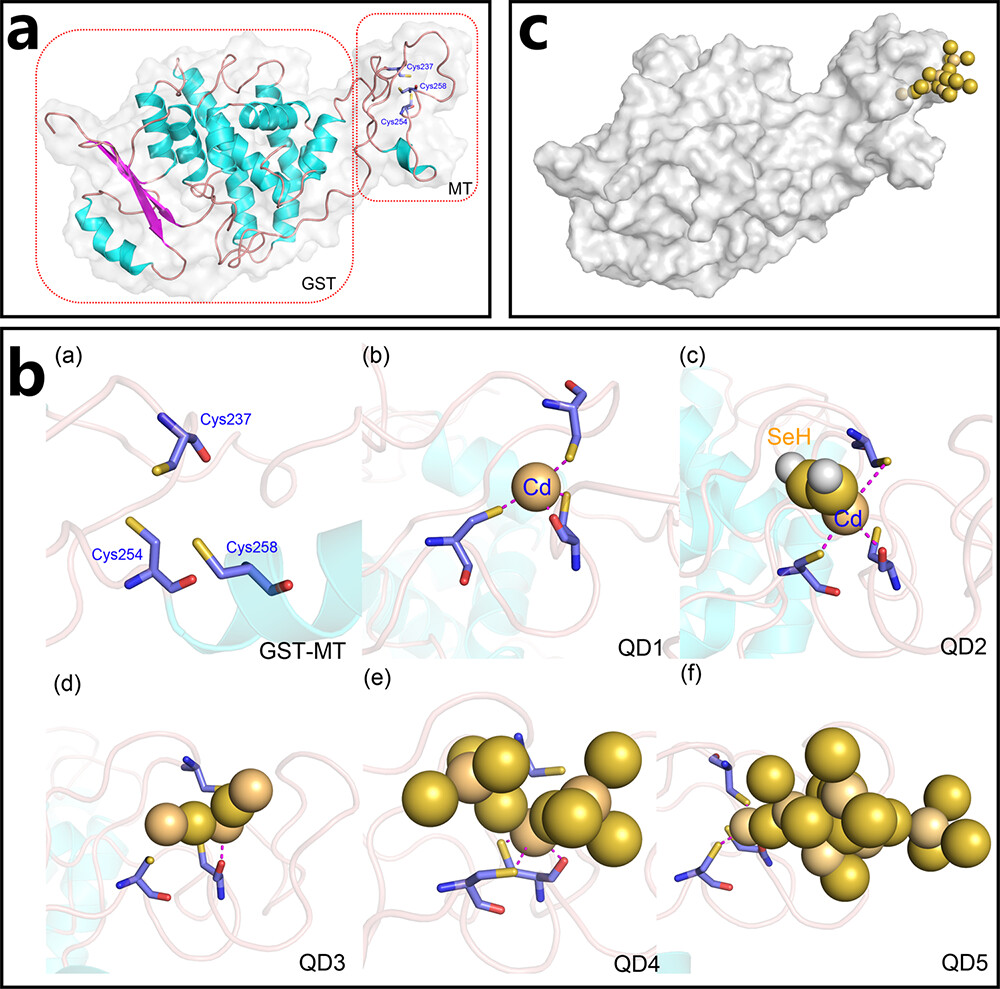
图2 金属硫蛋白介导的生物量子点组装。(a) GST-MT蛋白的初始结构(形成量子点的位置用蓝色表示)。(b)合成过程中GST-MT蛋白与不同QD结构的相互作用模式(紫色虚线表示配合)。(c) QDs与GST-MT蛋白的结合模型
结论:
该文报道了一种在重组大肠杆菌中表达金属硫蛋白合成CdSe量子点的方法。合成的量子点聚集在细菌的两端,显示出良好的荧光性能,Stokes位移为140 nm。生物量子点的产率为2.91%。在这项研究中,利用紫外吸收光谱证明了GST-MT可以结合8倍的Cd2+。通过MD模拟研究了生物量子点在金属硫蛋白上组装的分子机制,预测了量子点合成过程中涉及的关键半胱氨酸位点,分析了CdSe量子点的初始合成机制。综上所述,该文建立了一条绿色、温和、高效的量子点体内合成途径。为利用金属硫蛋白制备其他类型的量子点提供了参考,并对量子点的生物合成机理提供了更深入的理解。