CADD基础—蛋白质的二级结构
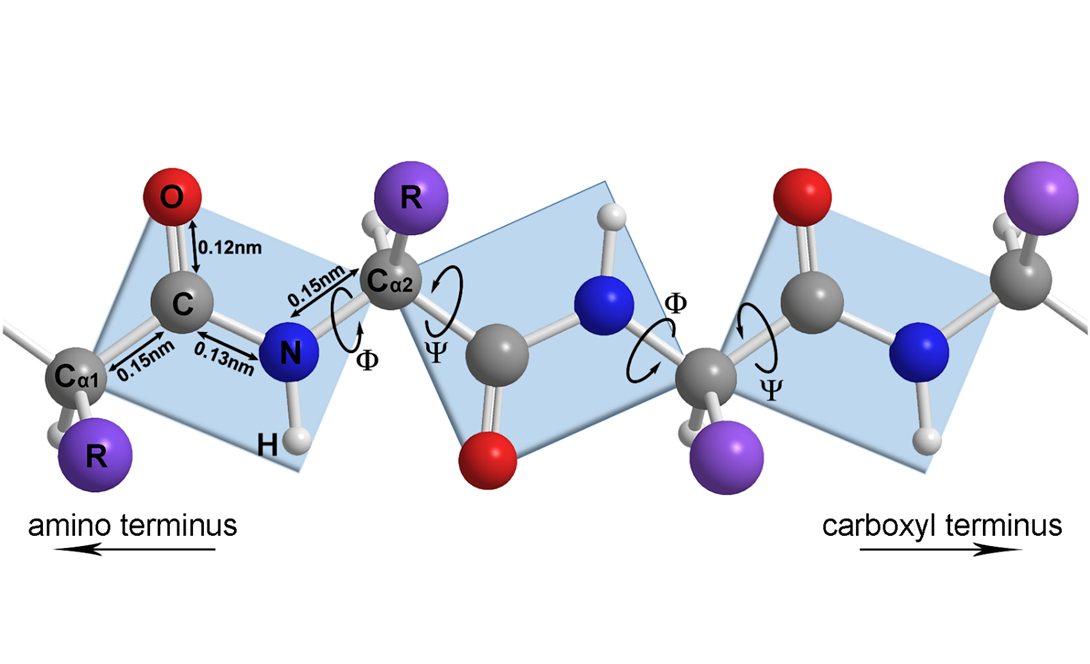
蛋白质的二级结构(secondary structure)是指蛋白质内某一段肽链骨架(-HN-Cα-CO-)的局部空间结构,不涉及氨基酸残基侧链的构象。主要包括:α-螺旋、β-折叠、β-转角和无规卷曲等。形成二级结构的基础是肽键中N上的孤对电子与羰基的π键形成p-π共轭,使肽键具备部分的双键性质,而不再是可以自由旋转的单键。参与形成肽键的Cα1、CO、NH和Cα2共6个原子位于一个平面内,且Cα1与 Cα2总是呈反式(trans)构型;而连接相邻两个肽平面或肽单元(peptide unit)的Cα原子形成的共价键是两个普通的σ键,理论上可任意转动,使得肽单元间存在一定的空间位置,如图1所示。
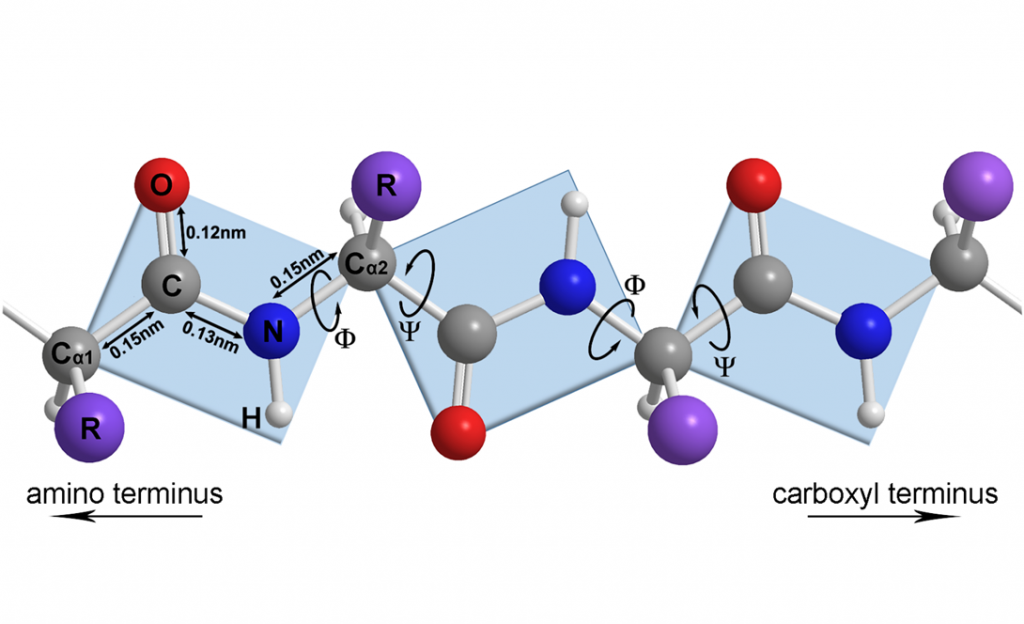
图1 肽单元
α-螺旋 α-螺旋(α-helix)是一种常见的蛋白质二级结构,如图2所示。在α-螺旋中,螺旋呈顺时针方向,螺旋上升一圈需要3.6个氨基酸残基,螺距为0.54 nm;每个肽键的-NH-和第四个肽键的-CO-形成氢键(hydrogen bond),且方向基本与螺旋长轴平行,以维持α-螺旋的稳定。在20种基本氨基酸中,Ala、Glu、Leu和Met是α-螺旋中的常见氨基酸。
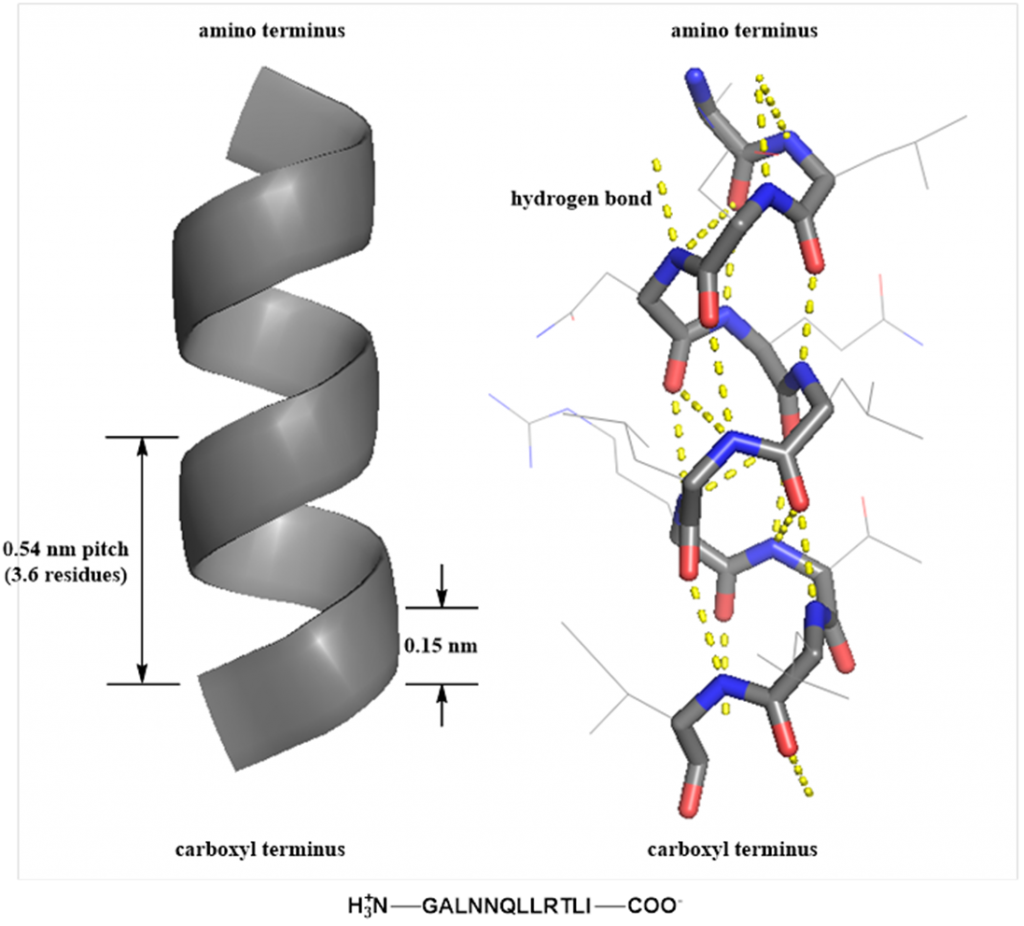
图2 α-螺旋
β-折叠 β-折叠(β-pleated sheet)与α-螺旋均为蛋白质二级结构的主要形式。β-折叠为舒展的锯齿状片层结构,一般由5-8个氨基酸残基构成,氨基酸残基的侧链交替分布于片层的上下方。片层与片层间可以平行排列,也可通过回折呈反平行走向,并依靠层间的-CO-与-NH-形成氢键维持稳定,如图3所示。
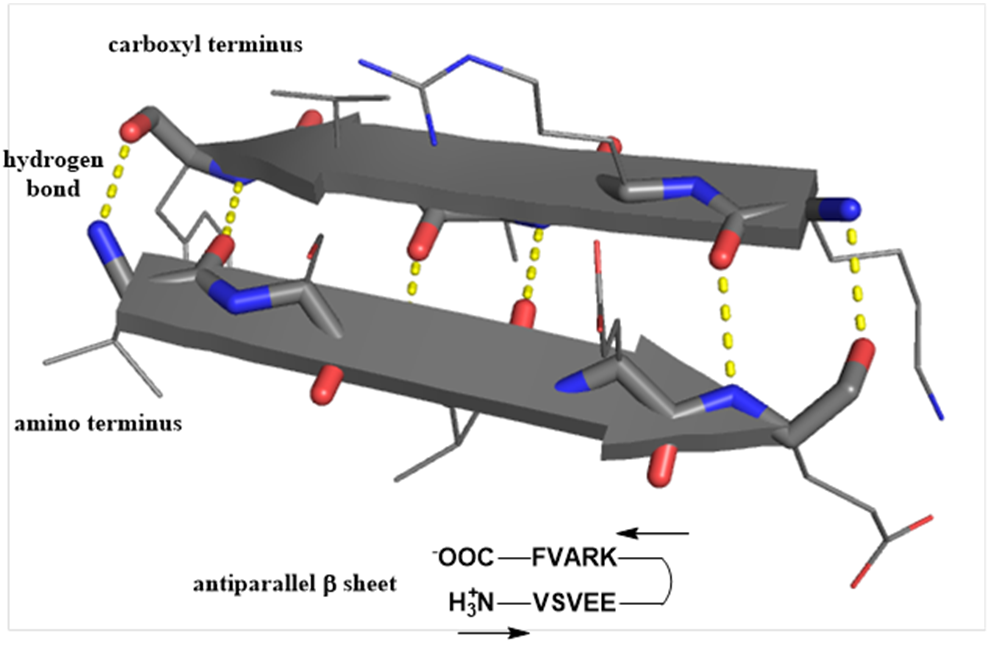
图3 β-折叠
β-转角和无规卷曲 β-转角(β-turn)一般由4个氨基酸残基组成,第一个残基的-CO-与第四个残基的-NH-形成氢键,通常第二个氨基酸残基是Pro,Gly、Asp、Asn和Tsp也是β-转角中的常见氨基酸残基。此外,将含有5个及以上氨基酸残基组成的转角称为环(loop);无规卷曲(random coil)则是没有确定规律的肽链结构。由于其侧链间的相互作用较小,使得无规卷曲易受到溶剂分子的碰撞而扭曲。但这种大柔性结构往往出现在酶的活性部位和一些蛋白质的功能区,具有一定的生物学意义。
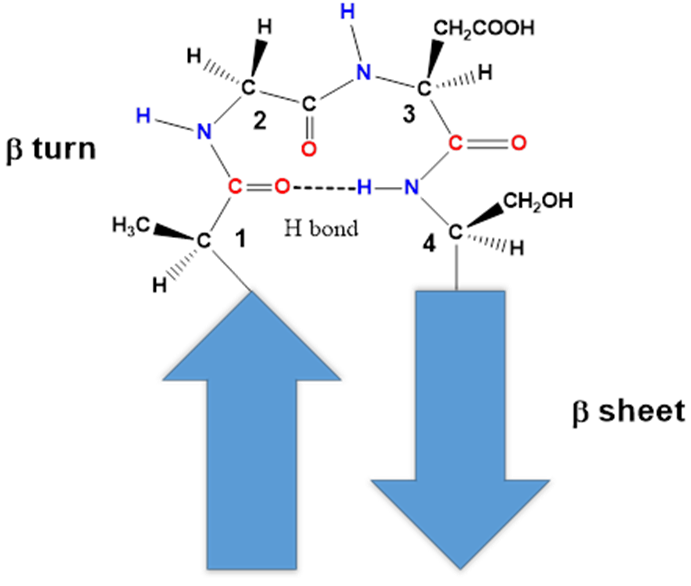
图4 β-转角
超二级结构与模体 由于非极性氨基酸间的相互作用,α-螺旋之间、β-折叠之间、α-螺旋与β-折叠之间在空间上相互靠近形成有规则的组合,称为超二级结构(super-secondary structure)。常见的超二级结构有αα、βαβ、ββ等,如图5所示。模体(motif)是指蛋白质分子中具有特定空间构象和功能的结构,是一种特殊的超二级结构。具体的表现形式有α-螺旋-β-转角-α-螺旋、链-β-转角-链、链-β-转角-α-螺旋-β-转角-链等。锌指(zinc finger)结构也是一种独特的超二级结构,常见于能与DNA或RNA结合的蛋白质中。锌指结构由1个α-螺旋和2个反向平行的β-折叠组成,形似手指;锌离子位于其围成的空腔中,与N-端的2个Cys和C端的2个His配位形成稳定的四面体结构。
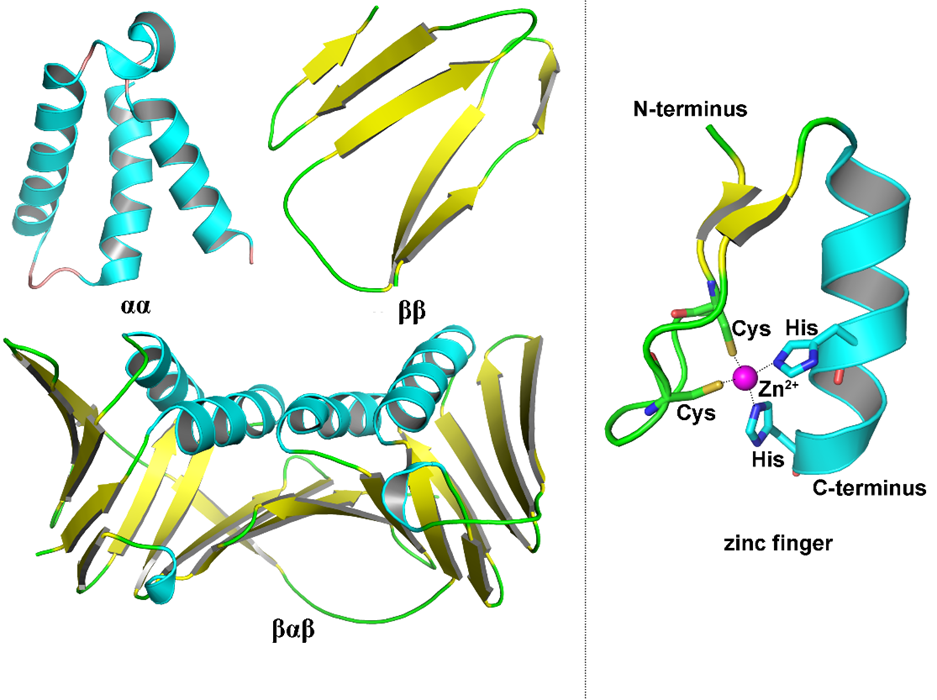
图5 常见超二级结构与锌指结构