合作单位:Chinese Academy of Medical Sciences and Peking Union Medical College
参考文献:Zhao L, Yang KQ, Fan P, et al. RET c.1901G>A and Novel SLC12A3 Mutations in Familial Pheochromocytomas. Genes, 2022 May 12; 13(5):864. doi: 10.3390/genes13050864. PMID: 35627249; PMCID: PMC9140906. (IF=4.141)
背景:
PHEO(嗜铬细胞瘤,OMIM #171300)是一种源自肾上腺髓质的神经内分泌肿瘤,可以是散发性的,也可以是家族性的。这是一种罕见的继发性高血压病因。PHEO患者通常表现为剧烈头痛、心悸和出汗过多的典型三联征,这些症状总是发作性的。手术切除功能性肿瘤(也称为产生儿茶酚胺的肿瘤)已被证明可有效缓解症状和改善预后。
家族性 PHEO 作为常染色体显性遗传性状遗传。Neumann及其同事指出,超过35%的PHEO可归因于种系致病突变。位于染色体10q11.2上的RET(转染过程中重排)原癌基因于1993年首次被发现与遗传性PHEO相关。此后,已检测到至少20个易感基因具有种系突变,如NF1(神经纤维瘤病1型)、TMEM127(跨膜蛋白127)、FH(富马酸水合酶)、VHL(Von Hippel-Lindau)等。现在建议所有PHEO患者进行基因测序。遗传性PHEO也可能是特定临床综合征的一种表型,如多发性内分泌肿瘤2A型和B型(MEN2A,OMIM #171400和MEN2B,#162300)、NF1(OMIM #162200)和VHL综合征(OMIM #193300)。
在这项研究中,对 PHEO 患者进行了基因筛查,发现他们携带 RET c.1901G>A 突变,并最终被诊断出患有家族性MEN2A。近年来,关于影响PHEOs在MEN2A中外显率的因素存在很多争议。例如,Mucha等报道,MEN2A中PHEO的外显率和诊断年龄与RET突变位置相关:RET外显子11的外显率估计为47%,外显子10携带者的外显率为30%。Castinetti等表明,即使在RET密码子634突变携带者中,外显率也可能因患者来源的地理区域而有很大差异,这表明未知修饰因子的作用。在这项研究中,发现 MEN2A 家族携带 RET c.1901G>A 突变,旨在确定该突变对 MEN2A 中 PHEO 外显率的影响。除了RET c.1901G>A突变外,还发现患者在SLC12A3中还存在一种新的变异(溶质载体家族12成员3),该变异与Gitelman综合征高度相关(GS,OMIM#263800)。通过使用蛋白质结构预测和比较模型来评估SLC12A3突变体的功能。目前,尚无研究报道同一患者或家庭同时发生RET和SLC12A3突变。本工作是第一个在MEN2A家族中描述化合物RET c.1901G>A和SLC12A3突变的人。该研究还强调了基因检测对疾病预防、治疗和预后的重要性。
方案设计:
为了确定SLC12A3蛋白及突变体的三维结构,深入研究蛋白的结构与功能的关系。通过与魔德科技技术团队沟通,拟通过同源模建方法对SLC12A3的蛋白结构进行了预测,并利用PROCHECK(3.5.4版)和Verify 3D 程序对优化的蛋白质模型进行评估,以确保蛋白质结构合理
主要结果:
对先证者进行WES分析。经过数据筛选,本工作在RET的外显子11中检测到c.1901G>A [p.Cys634Tyr,密码子634中的氨基酸从半胱氨酸(Cys)变为酪氨酸(Tyr)]突变(图1),以及SLC12A3外显子26的新变异,c.3070_3079delinsCAG(图2)。没有发现其他有意义的突变。Sanger测序发现,母本携带与先证者相同的突变。RET 基因中的错义突变将编码区的碱基 1901 从 G 变为 A,从而将翻译的氨基酸从半胱氨酸变为酪氨酸。SLC12A3基因的移码缺失变体涉及编码区中碱基 3070 至 3079 的缺失以及在该位置插入 CAG 碱基。根据 Mutalyzer(https://mutalyzer.nl/,2020 年 10 月 20 日访问),这种 SLC12A3 变体导致翻译氨基酸的变化,即从1024 个氨基酸位置开始,并在另外 10 个氨基酸翻译后终止 (p.Val1024Glnfs*10)。此外,使用 Provean(http://provean.jcvi.org-/index.php,2020 年 10 月 20 日访问)、PolyPhen-2(http://genetics.bwh.h-arvard.edu/pph2,2020 年 10 月 20 日访问)、SIFT(http://sift.jcvi.org,2020 年 10 月 20 日访问)和 Mutation Taster(http://www.mutationtaster.org,2020 年 10 月 20 日访问)预测 RET c.1901G>A 突变是有害的。SLC12A3 c.3070_3079delinsCAG突变在突变品尝者中被预测为致病。根据2015年ACMG指南,c.3070_3079delinsCAG突变SLC12A3意义尚不确定。

图1.Sanger 测序确定了 RET 中的突变。
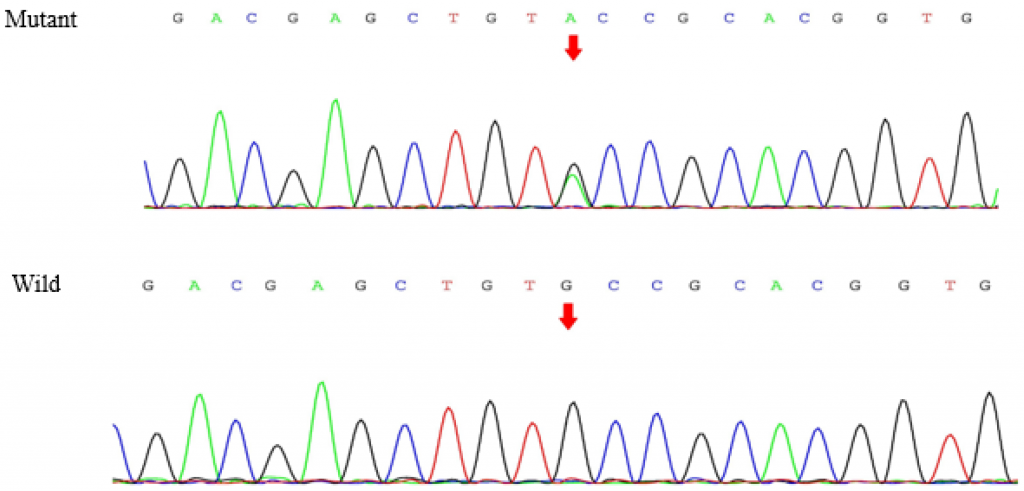
图2.Sanger测序确定了SLC12A3的突变。
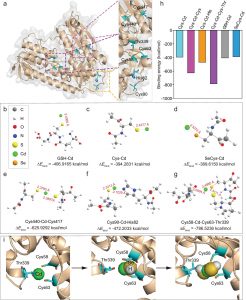
图3显示了由SLC12A3编码的蛋白质和突变体(SLC12A3 c.3070_3079delinsCAG)的结构预测模型。野生型蛋白具有由两条链组成的二聚体结构,突变位点位于蛋白质的C端区域。该区域的突变可能导致蛋白质的结构变化,从而影响蛋白质的功能。
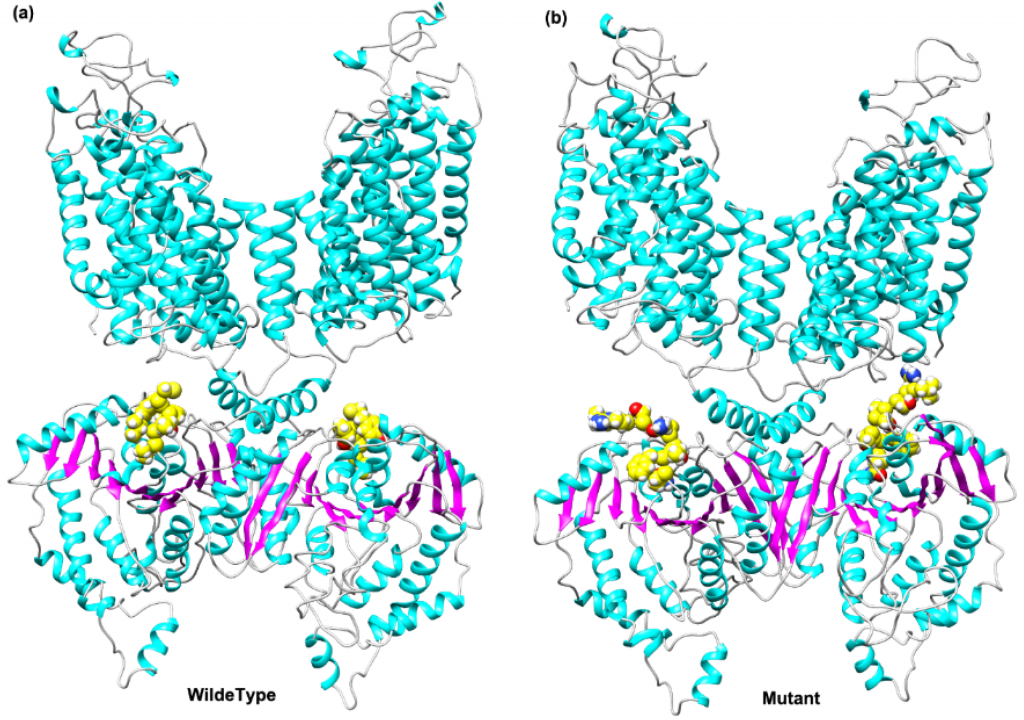
图3.由SLC12A3(a)和突变体(SLC12A3 c.3070_3079delinsCAG)(b)编码的蛋白质的结构模型。黄色球体表示突变的氨基酸残基。
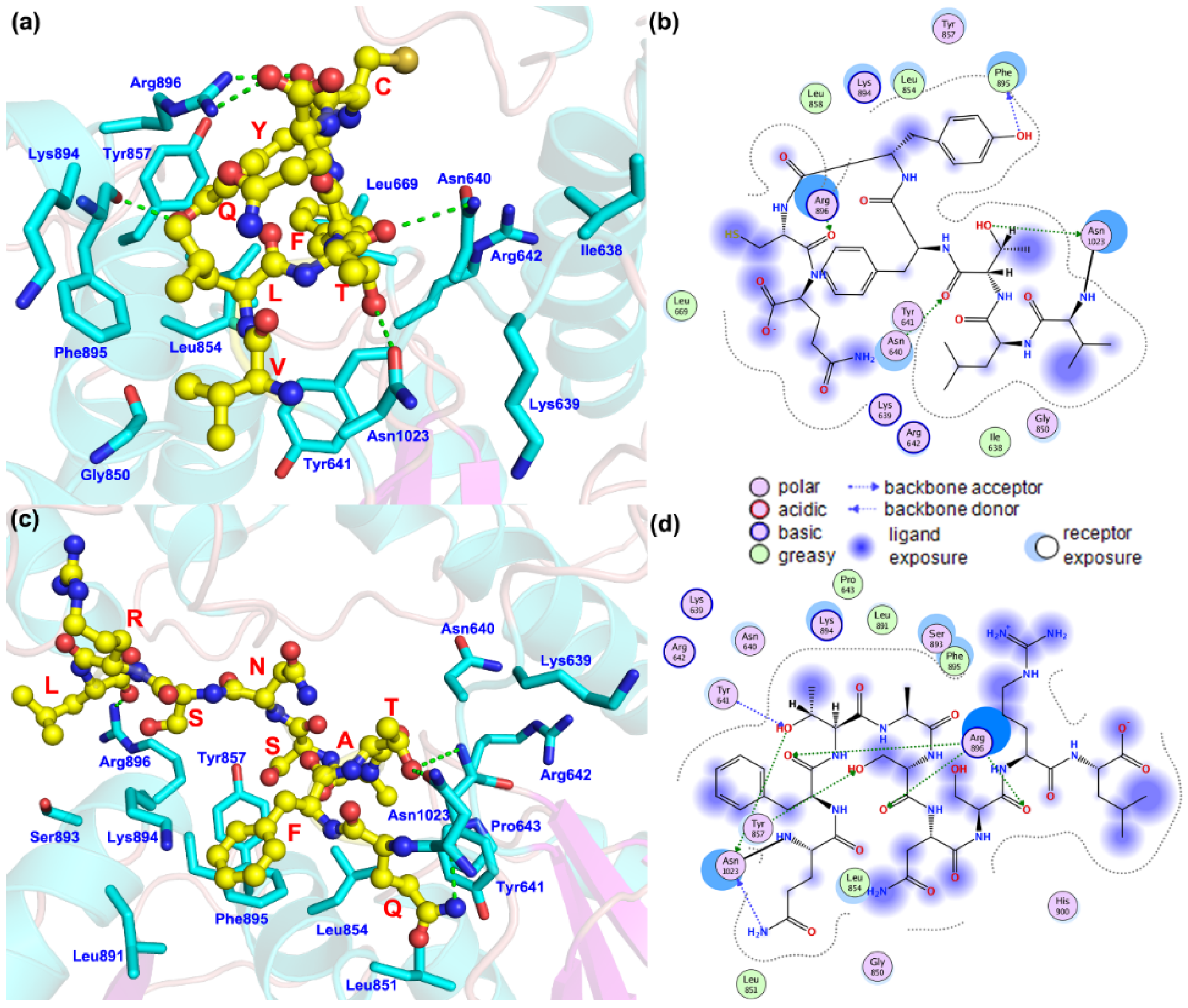
为了研究SLC12A3 c.3070_3079delinsCAG的影响,图4显示了蛋白质的结构和突变体的位置。野生型C端氨基酸为Asn1023-VLTFYC-Gln1030(天冬酰胺1023-缬氨酸-亮氨酸-苏氨酸-苯丙氨酸-酪氨酸-半胱氨酸-谷氨酰胺1030),对于突变体,预测蛋白质结构的C端氨基酸为Asn1023-QFTASNSR-Leu1032(Asn1023-谷氨酰胺-苯丙氨酸-苏氨酸-丙氨酸-丝氨酸-精氨酸-亮氨酸1032)。蛋白质末端氨基酸与氨基酸残基之间的相互作用模式发生了显著变化。在野生型蛋白中,该序列可以与 Asn640、苯丙氨酸 895(Phe895)、精氨酸 896 (Arg896)和Asn1023形成氢键相互作用,并且可以与异亮氨酸 638(Ile638)、Leu669、Leu854、Leu858 和 Phe895 形成强疏水相互作用。在突变体的预测结构中,氨基酸数量增加,主要与酪氨酸857(Tyr857)、Arg896和Asn1023形成氢键,并与脯氨酸643(Pro643)、Leu851、Leu854、Leu891和Phe895形成疏水相互作用。
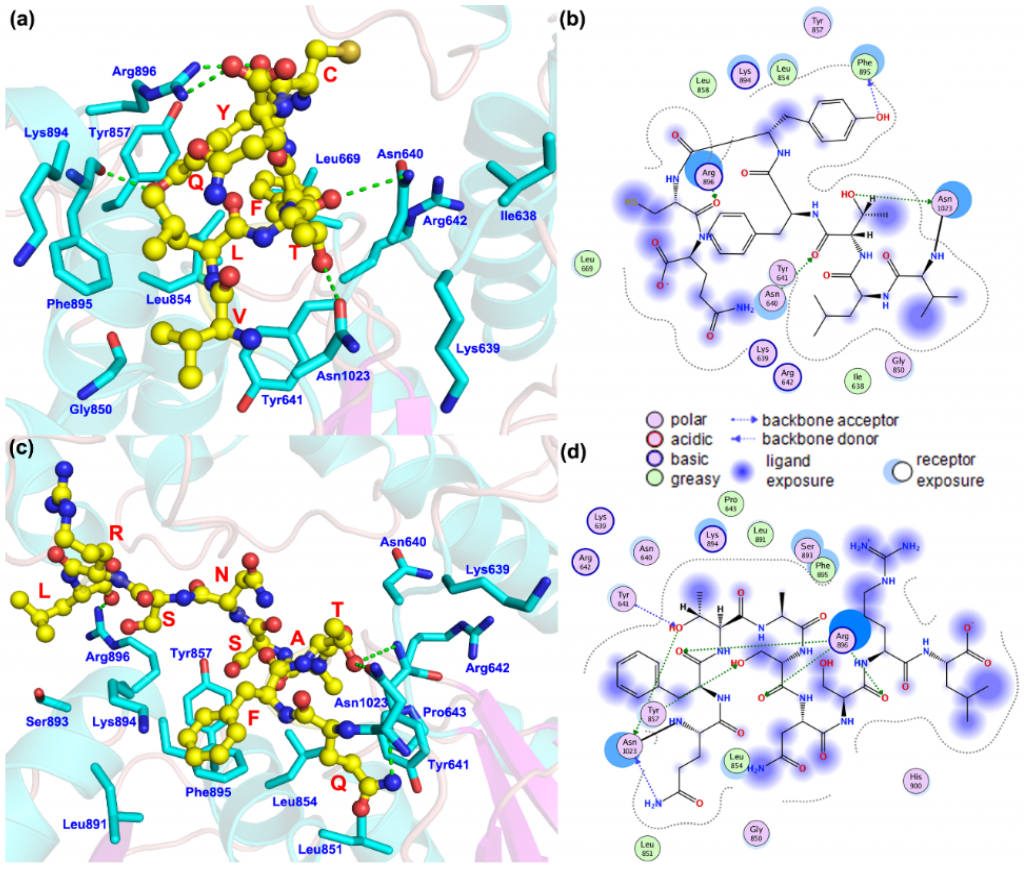
图4.(a,b):SLC12A3编码的蛋白质中C端氨基酸与周围氨基酸残基之间的相互作用模式。(c,d):由c.3070_3079-delinsCAG编码的预测蛋白质中C末端氨基酸与周围氨基酸残基之间的相互作用模式SLC12A3。黄色球体表示突变的氨基酸残基。
总之,这种新型SLC12A3变体不仅可以破坏蛋白质氨基酸与附近氨基酸之间的氢键,还可以极大地影响其他相互作用,包括疏水和极性相互作用。通过分析蛋白质突变点的位置和突变体的结构,从理论上解释了SLC12A3 c.3070_3079delinsCAG可能影响氨基酸残基的相互作用,破坏蛋白质本身的稳定性,并最终影响蛋白质的功能。
结论:
综上所述,本工作是第一个在MEN2A家族中描述化合物RET c.1901G>A和c.3070_3079-delinsCAG突变的新SLC12A3。具有 RET c.1901G>A 突变的 MEN2A 患者往往具有双侧 PHEO,其 PHEO 可能比 MTC 更早出现。SLC12A3的新变体与MEN2A的表型无关,但会影响蛋白质的功能。预防医学和癌症遗传学是现代医学中高度相互关联的专业,其重要性与日俱增。需要对基因突变的表型和相关机制进行更多研究,以指导个体评估和治疗。