合作单位:Tianjin University of Science and Technology
参考文献:JL Li, LY Jiang, et al. Improving the activity and stability of Bacillus clausii alkaline protease using directed evolution and molecular dynamics simulation. Enzyme and Microbial Technology, 2021, 147, 109787. DOI: 10.1016/j.enzmictec.2021.109787 (IF=2.923)
背景:
合成洗涤剂被用作清洁剂已有100多年的历史。就这样,合成洗涤剂成为世界各地人们日常生活中不可或缺的一部分。另一方面,合成洗涤剂中磷酸盐等成分对生态系统的负面影响正在逐渐被认识到。因此,洗涤剂酶作为洗涤剂中有害化学物质的环保替代品,迅速发展成为包括蛋白酶、脂肪酶、淀粉酶和纤维素酶在内的大领域。此外,据报道,含有酶的洗涤剂比普通洗涤剂更有效,因为它们能够在不损坏织物的情况下溶解顽固的污渍。洗涤剂行业通常使用的酶是碱性酶,因为洗涤剂的pH值通常在9.0至12.0之间。在用于洗涤剂的碱性酶中,碱性蛋白酶先导化合物占全球蛋白酶销售额的40%。洗涤剂工业中使用的碱性蛋白酶通常来源于克劳西芽孢杆菌(PRO)、淀粉淀粉芽孢杆菌(BPN)、地衣芽孢杆菌(Carlsberg)和长发芽孢杆菌(BgAP)。其中,PRO因其在洗涤剂条件下保持活性的能力而在洗涤剂中使用最广泛。因此,通过提高乳酸芽孢杆菌活性来改进源自克劳氏芽孢杆菌的碱性蛋白酶,对于降低洗涤剂蛋白酶成本和提高其生产效率的问题具有重要作用。
目前,改善蛋白酶酶特性的方法主要是合理设计和定向进化。与定向进化相比,合理设计是一种有效的方法,可以构建一个小而有效的突变库,以改善酶的性质。但是,使用理性设计存在某些缺点。它依赖于可靠的蛋白质结构和结构-功能关系,因此在改善酶的性质方面往往不能令人满意。与理性设计相比,定向进化是一种更现实的方法,通过使用容易出错的PCR或DNA洗牌构建包含随机突变的大型突变库来增强酶的酶学特性,从而通过有效筛选和选择突变文库来鉴定具有理想性能的突变体,而无需详细的结构信息。此前,易出错的PCR用于提高嗜碱性芽孢杆菌和小芽孢杆菌碱性蛋白酶的活性,从而产生变异体E110A/E134A和P9S/K27Q/T162I,活性分别增加380%和约500%。此外,据报道,使用易出错的PCR生成的BgAP突变体MF1(I21V,S39E,N74D,D87E,M122L,N253D)在60℃下的半衰期延长100倍。迄今为止,几乎没有进行任何工作来改善碱性蛋白酶的酶促性质,导致对碱性蛋白酶的结构-功能关系的理解不足。
该研究旨在获得具有改进特异性活性的PRO变体。因此,研究使用容易出错的PCR生成了一个随机的PRO突变体文库,并使用高通量筛选方法对其进行筛选。由此,获得了具有增加比活性和提高稳定性的变体。此外,利用分子动力学模拟(MD)对变异体的蛋白质结构进行评估,以探索其提高催化效率和稳定性的分子机制,以期提高对酶结构-功能关系的理解,并为后续修饰提供基础。
方案设计:
为了研究碱性蛋白酶及突变体与底物之间的相互作用,探索了复合物之间的亲和力。通过与魔德科技技术团队沟通,拟联合通过分子力学和量子化学方法研究突变体蛋白结构的变化,讨论能有效提高催化效率和稳定性的有效突变。
主要结果:
筛选了大约4600个突变体,以确定那些在60℃下具有增强活性的突变体。大约540个突变体显示出活性,4个突变体在使用96孔板进行初步筛选后表现出活性增加。随后,通过在250 mL摇瓶中的随访培养获得1个活性提高的突变体。突变体的测序显示一个突变位点的核苷酸改变,导致成熟肽(Gly95Pro)核苷酸序列中的GGG→CCG取代。该G95P突变体被用于分子动力学模拟分析G95P稳定性和催化效率提高的分子机制,以分析该特定氨基酸取代的影响。
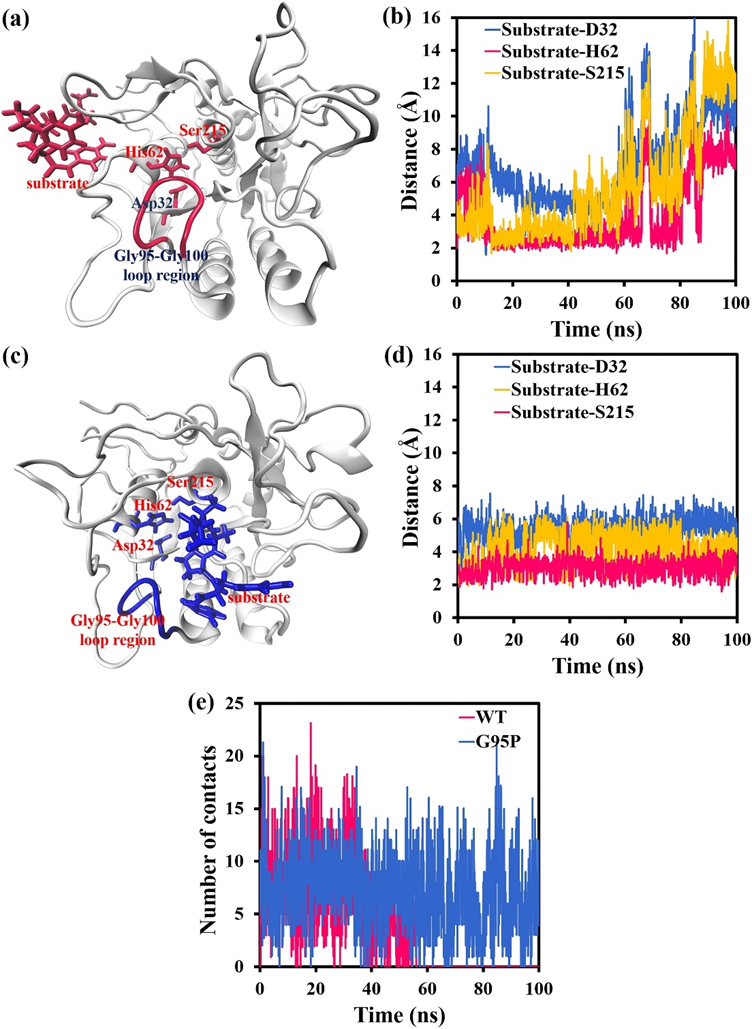
为了研究Gly95Pro突变对底物与活性位点结合的影响,首先在MD模拟结束时,在不同的模拟系统中获得了蛋白酶及其AAPF底物的复合构象。WT蛋白酶/G95P突变体中活性位点Asp32、His62和Ser215与AAPF底物之间的距离随模拟时间的变化而变化,以100 ns计算。结果如图1a-d所示。在图1a中,在MD模拟结束时,AAPF底物从WT蛋白酶中的活性位点Asp32、His62和Ser215中完全去除,而Gly95-Gly100环区相对靠近这些活性位点。如图1b所示,60 ns后,AAPF底物开始远离WT蛋白酶中的活性位点,90 ns后,AAPF底物从WT蛋白酶的活性位点完全去除。AAPF与活性位点残基Asp32/His62/Ser215之间的距离大于7 Å,最大为16 Å。底物与这些活性位点之间的大距离导致WT蛋白酶失去其催化活性。如图1c所示,在MD模拟结束时,AAPF底物仍停留在G95P突变体的催化位点附近,Pro95-Gly100环区与AAPF底物接触。图1d显示,G95P突变体与AAPF底物的活性位点之间的距离在100 ns内保持稳定,AAPF与活性位点残基Asp32/His62/Ser215之间的距离不超过7 Å,使G95P突变体保持其催化功能。
如图1c所示,Gly/Pro95-Gly100环区也可以与AAPF底物相互作用,表明环区的结构稳定性会影响底物与活性位点之间的结合。为了更直观地考虑MD模拟过程中Gly/Pro95-Gly100环区与AAPF底物之间的接触,WT蛋白酶/G95P突变体的Gly/Pro95-Gly100环区与AAPF底物之间的接触数计算为100 ns模拟时间的函数,结果如图1e所示,在MD模拟过程中,G95P突变体中Pro95-Gly100环区与AAPF之间的接触数量保持相对稳定,AAPF始终可以与该环区接触和相互作用。然而,60 ns后,WT蛋白酶中的Gly95-Gly100环区与AAPF之间没有接触,表明AAPF已从Gly95-Gly100环区和催化活性位点Asp32、His62和Ser215中完全去除(图1b)。如上所述,WT蛋白酶中Gly95-Gly100环区的稳定性较低,Gly95Pro突变可以显著降低环区的RMSF值,提高其稳定性。在MD模拟的早期阶段,WT蛋白酶和G95P突变体中的Gly/Pro95-Gly100环区可以与AAPF接触并相互作用。这些数据表明,Gly95-Gly100环区可以通过影响AAPF底物间接影响蛋白酶的催化效率。当Gly95-Gly100环区的稳定性较低时,它可以通过直接与AAPF底物相互作用来影响AAPF底物,从而影响AAPF与活性位点之间的相对位置(图1b)。Gly95-Gly100区域的不稳定性使AAPF逐渐远离该环区,进而远离蛋白酶的活性位点,最终降低了蛋白酶的催化效率。当Pro95-Gly100区域的稳定性较高时,该环区对AAPF底物的影响很小,并且始终与AAPF接触,因此AAPF与活性位点之间的相对位置保持不变(图1d)。Gly95-Gly100环区稳定性的提高使AAPF底物稳定下来,使其保持在蛋白酶的催化位点附近,在很大程度上保持了蛋白酶的催化效率。
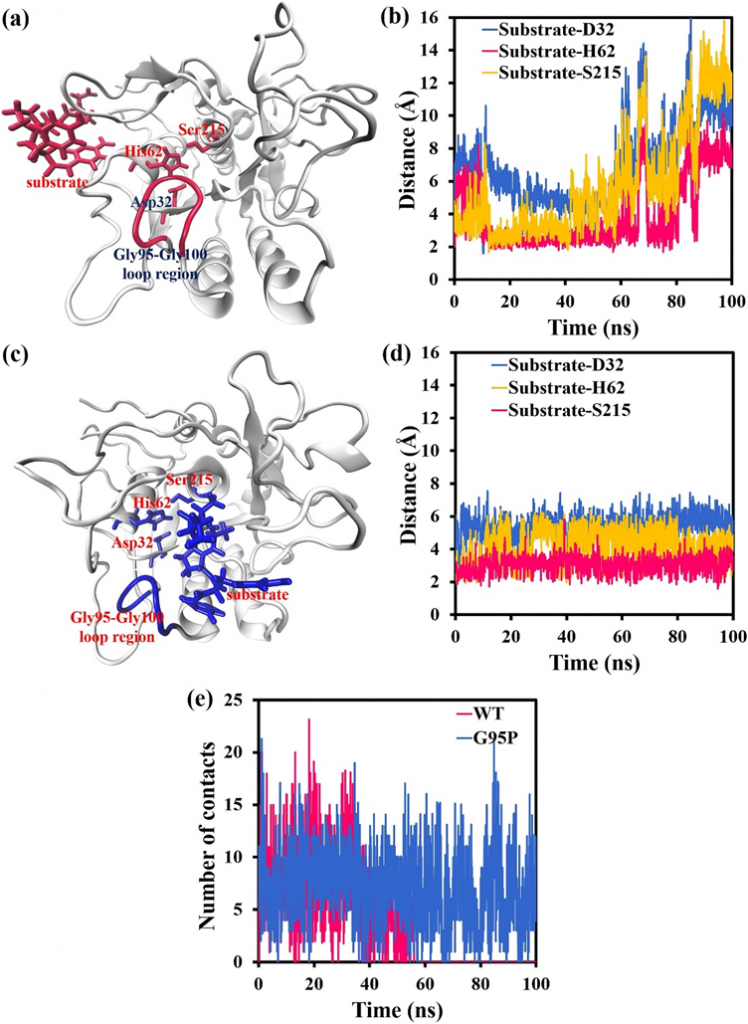
图1.Gly95Pro突变对底物和活性位点之间结合的影响。(a)MD模拟结束时WT蛋白酶和AAPF底物的复合构象。(b)WT蛋白酶活性位点与AAPF底物之间的最小距离随100 ns的模拟时间而变化。(c)MD模拟结束时G95P突变体和AAPF底物的复合构象。(d)G95P突变体和AAPF底物的活性位点之间的最小距离随100 ns的模拟时间而变化。(e)WT蛋白酶/G95P突变体的Gly/Pro95-Gly100环区与AAPF底物之间的接触次数随100 ns的模拟时间而变化。
精氨酸作为一种碱性氨基酸,能与附近的酸性氨基酸形成盐桥相互作用。作为一种强非键合相互作用,盐桥有助于酶的结构稳定性。为了探究残基Arg19与附近残基之间的相互作用,在MD模拟开始时获得了蛋白酶中残基Arg19附近区域的构象,结果如图2a所示。残基Arg269和残基Asp265之间也可以形成另一种盐桥;然而,残基Arg19和Asp265之间的盐桥可以连接两个不同的区域(图2a),这比残基Arg269和Asp265之间的盐桥对蛋白酶的结构稳定性贡献更大。WT蛋白酶中残基Arg19附近区域的稳定性较低,这可能意味着Arg19-Asp265盐桥被破坏。因此,WT蛋白酶/G95P突变体中残基Arg19的侧链与残基Asp265的侧链之间的计算间距随100 ns的模拟时间而变化,这些结果如图2b所示。在100 ns的模拟时间内,G95P突变体中残基Arg19的侧链与残基Asp265的侧链之间的距离稳定在4 Å左右,但WT蛋白酶中残基Arg19的侧链与残基Asp265的侧链之间的距离在50 ns后突然增加到最大18 Å。为了更直观地考虑Gly95Pro突变对Arg19-Asp265盐桥的影响,在MD模拟结束时获得了WT蛋白酶和G95P突变体中残基Arg19附近区域的构象,这些结果如图2c和d所示。如图2c所示,与MD模拟的初始阶段相比,WT蛋白酶的残基Arg19和Asp265之间的间距显著增加(图2a),并且Arg19-Asp265盐桥被破坏。如图2所示,Arg19-ASP265和ASP265-Arg269盐桥可以保持。这些数据表明,Gly95Pro突变确实可以稳定Arg19-Asp265盐桥,而在WT蛋白酶中,Arg19-Asp265盐桥最终被蛋白酶的不稳定性破坏。
一般来说,碱性氨基酸在强碱性环境中容易失去H离子,并转化为未解离的氨基酸。pH值越高,这种现象越明显。然而,精氨酸是相对于赖氨酸和组氨酸的强碱性氨基酸。根据使用在线工具H++的计算,即使在pH值为12精氨酸的环境中,蛋白酶也不会失去H离子;因此,在MD模拟中,蛋白酶中的所有精氨酸都处于解离状态。即使在pH值为12的环境中,蛋白酶中的精氨酸也不会大量失去其H离子。因此,在MD模拟中,WT蛋白酶/G95P突变体中的所有精氨酸都处于解离状态。然而,在现实中,酸性或碱性氨基酸的解离态和非解离态是动态平衡的。即使使用精氨酸,有时侧链中的胍也会失去H离子。当这种情况发生时,盐桥的影响会暂时消失。这种现象意味着,尽管在MD模拟的早期阶段,Arg19-Asp265盐桥得以维持,但在实践中,由于酸性或碱性氨基酸的解离平衡,Arg19-Asp265盐桥会暂时消失。考虑到WT蛋白酶中Arg19附近区域的稳定性较差,这种现象增加了Arg19-Asp265盐桥在强碱性环境中被破坏的可能性,从而破坏了WT蛋白酶的稳定性。G95P突变体在强碱性环境中能较好地维持盐桥,从而显著增强蛋白酶的稳定性。
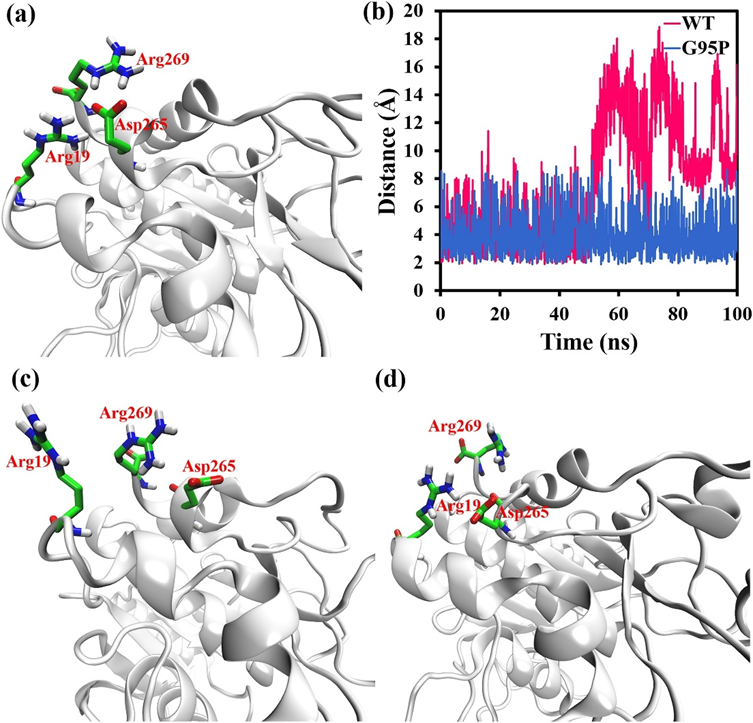
图2.Gly95Pro突变对盐桥稳定性的影响。(a)MD模拟初始阶段蛋白酶中残基Arg19及其周围区域的构象。(b)WT蛋白酶/G95P突变体中残基Arg19与残基Asp265侧链之间的最小距离随模拟时间为100 ns而变化。(c) MD模拟结束时WT蛋白酶中残基Arg19及其周围区域的构象。(d)MD模拟结束时G95P突变体中残基Arg19及其周围区域的构象。
结论:
在这个研究中,从使用易出错的PCR构建的突变体库中鉴定出一种新的PRO突变体G95P,该突变体具有增强的比活性、热稳定性和碱稳定性。MD模拟研究表明,Gly95Pro突变提高了Arg19-Asp265盐桥和Gly95-Gly100环区的稳定性。此外,Pro95-Gly100环区可以与AAPF稳定地相互作用,导致AAPF留在催化位点附近。该工作增强了对PRO中结构-功能关系的理解,为提高PRO的酶学特性以满足蛋白质工程的工业要求提供了学术基础。