合作单位:Peking University Cancer Hospital & Institute
参考文献:ShanMei Chen, ChuanKe Zhao, LiCheng Yao, et al. Acta Pharmacologica Sinica, 2022. DOI:10.1038/s41401-022-00940-4(IF =8.2)
背景:
既往研究表明,全世界90%的癌症相关死亡是由转移引起的,然而有效的治疗药物却很少。临床证据表明,淋巴管对肿瘤细胞传播的介导作用是血管的3-5倍,因此,淋巴管已成为发展治疗转移策略的重要靶点。
淋巴管生成受多种生长因子调控,其中VEGF-C-VEGFR3信号被认为是最基本、最特异的通路。大量的临床前证据表明,在不同的动物模型中,干扰VEGF-C-VEGFR3信号可以减弱肿瘤淋巴管生成和转移。因此,靶向VEGF-C-VEGFR3通路是治疗淋巴转移的潜在选择。
天然产物种类丰富,是预防和治疗人类疾病的重要药物来源。从天然产物中开发先导化合物是一种很有前途的癌症治疗策略。Aiphanol,一种天然的二苯乙烯木脂素,最初被报道具有抑制环氧化酶-1和环氧化酶-2 (COX1/COX2)活性的作用。也发现Aiphanol通过同时抑制VEGFR2和COX2的活性来抑制血管生成,从而阻断肿瘤生长。而VEGFR3被筛选为Aiphanol靶向激酶亚群中排名第一的候选物。考虑到VEGFR3在淋巴管生成中的关键作用,本文研究Aiphanol是否有可能通过钝化VEGFR3来抑制淋巴管生成和转移。结果表明,Aiphanol 是一种通过协同靶向 VEGFR3 和抑制 COX2-PGE2-VEGF-C 信号轴来预防淋巴管生成和淋巴传播的有吸引力的药物。
方案设计:
为了探索Aiphanol与VEGFR3之间可能的相互作用模式,经与魔德科技(www.modekeji.cn)技术团队沟通,拟通过分子对接方法探索Aiphanol与VEGFR3之间的结合方式。
主要结果:
根据预测,Aiphanol与VEGFR3的催化结构域结合,结合能为 -10.86 kcal/mol。为了分析Aiphanol与人源VEGFR3蛋白分子识别的驱动力,本文对二者的相互作用模式进行了分析,如图1a和1b所示。从图中可以看出,Aiphanol分子大部分位于人源VEGFR3蛋白的疏水性空腔中。具体来讲,Aiphanol分子主要结合在由Leu851、Ala877、Lys879、Glu896、Leu900、Val925、Val927、Glu928、Phe929、Cys930、Lys931、Tyr932、Asn934、Asn937、Leu1044、Asp1055、Phe1056组成的疏水性空腔中。其中Aiphanol分子两端苯环上的羟基分别与Asn934、Asn937和Asp1055形成三组氢键作用,同时Aiphanol分子中苯并二氧杂苯环上的羟甲基与Cys930和Lys931形成两组氢键。并且Aiphanol分子中的两个苯环和苯并二氧杂苯环与口袋周围的疏水性氨基酸(Leu851、Ala877、Lys879、Glu896、Leu900、Val925、Val927、Glu928、Phe929、Tyr932、Leu1044、Phe1056)形成了较强的疏水作用,进一步增强了Aiphanol分子与人源VEGFR3蛋白间的亲和力。
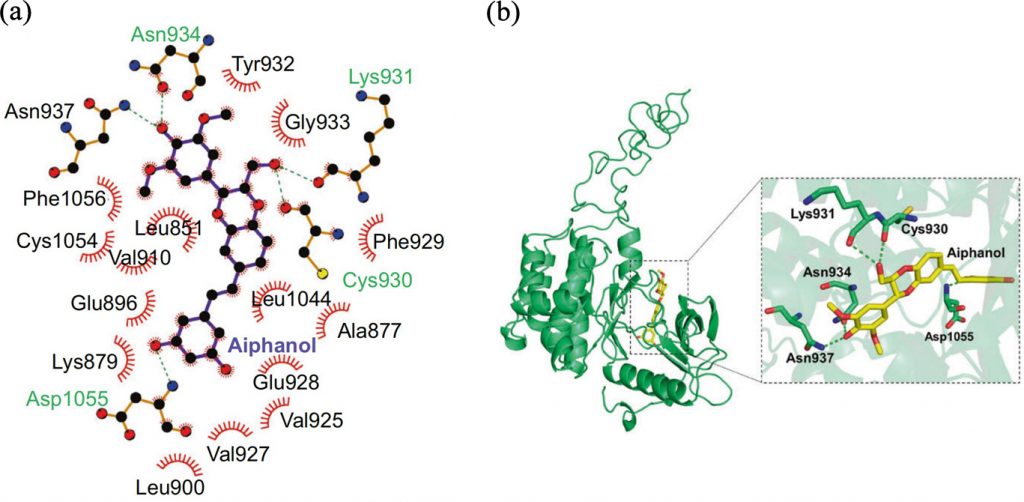
图1 Aiphanol与人源VEGFR3蛋白的结合模式图(a:Aiphanol与人源VEGFR3蛋白的二维结合模式,绿色虚线表示氢键作用,红色齿轮状表示疏水作用;b:Aiphanol与人源VEGFR3蛋白的三维结合模式图,绿色虚线表示氢键作用)