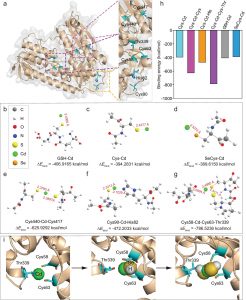
合作单位:Renmin University of China
参考文献:Meng-Ting Song, Wen-Zhu Wang, Yao Lu, et al. ACS omega, 2022. DOI:10.1021/acsomega.2c01226(IF = 4.1)
背景:
牛血清蛋白(BSA)是牛奶中乳清蛋白的主要成分,因其易于获得、稳定性高、能与多种配体结合,且在序列和构象上与人血清白蛋白( HSA)具有高度同源性,常被用来代替人血清白蛋白进行生物分析和生化研究。牛血清白蛋白是由三个结构同源的α-螺旋结构域(I、II、III)组成的心形单肽分子,每个结构域又分为A、B两个亚结构域,结构如图1a。芳香和杂环配体作为典型的药物分子,通常结合在BSA的两个疏水口袋内,即IIA亚结构域的1号位点和IIIA亚结构域的2号位点。
黄酮类化合物是多酚类化合物的一个亚类,其生理活性主要是抗氧化活性,包括自由基清除、金属螯合以及抑制形成活性氧(ROS)的酶活性。研究表明,在均相乙醇或水模型体系中,黄酮类化合物与金属离子或碱土金属离子结合时,自由基清除能力显著增强。黄酮类化合物的构象柔韧性和B环上羟基的数量显著影响黄酮类化合物与血清白蛋白的结合亲和力。黄酮类化合物与BSA和HSA的结合位点大多位于IIA结构域的1号位点。此外,金属离子作为微量营养素,金属蛋白是主要的结合形式,金属离子通过配位与BSA和HSA结合。
近年来,人们发现金属离子的存在改变了黄酮类化合物与牛血清白蛋白的结合,甚至引起牛血清蛋白构象的改变。金属离子对木犀草素与牛血清蛋白相互作用的影响已经被研究,但未考虑金属与黄酮类化合物的配合物形式。本研究选取抗氧化和抗炎活性最高的黄酮类化合物木犀草素(Lut),设计了包括BSA、Cu(II)和Lut的模型体系。在生理pH的水溶液中,Cu(II)与Lut的3 ‘,4 ‘位点单配位形成了1:1的Cu(II)-Lut配合物。并尝试解决以下问题:在水溶液中形成的Cu(II)-Lut配合物是否以配合物或随后的解离形式与牛血清白蛋白结合?Cu(II)与Lut的配位是否影响Lut与BSA的结合?在Cu(II)存在下,Lut在均相水溶液中显著增强的抗氧化活性是否转移到含有BSA的体系中,从而提供比Lut更好的抗氧化保护?
方案设计:
经与魔德科技(www.modekeji.cn)技术团队沟通,拟通过分子动力学方法模拟Cu(II)-Lut与BSA结合的稳定性和动力学以及BSA-Cu(II)-Lut配合物的构象结合模式。
主要结果:
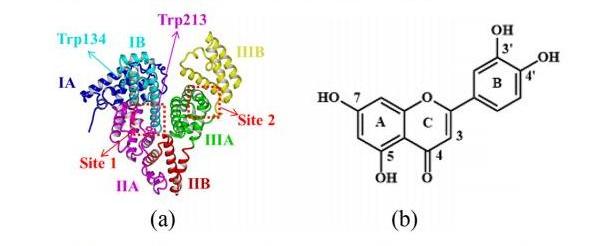
图1 (a)牛血清白蛋白(BSA)的晶体结构;(b)木犀草素(Lut)的分子结构
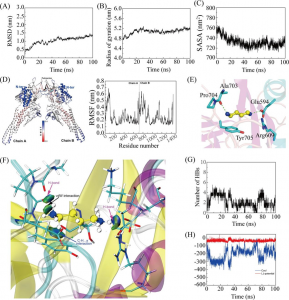
通过分析BSA骨架原子的均方根偏差(RMSD)、旋转半径(Rg)、和溶剂可及表面积(SASA)的变化来测试BSA-Cu(II)-Lut体系的稳定性,结果支持BSA-Cu(II)-Lut体系的MD计算是可靠的。为探究Cu(II)-Lut与BSA空腔结合的动力学或顺序,对50 ns模拟过程中的代表性构象进行了可视化,初始状态下,15个Cu(II)-Lut分子位于BSA外的溶液环境中,8 ns时,一个Cu(II)-Lut分子开始靠近BSA空腔位点2的活性口袋表面,而此时位点1尚未结合任何Cu(II)-Lut分子。25 ns时,Cu(II)-Lut与位点2结合,同时,第二个Cu(II)-Lut开始接近位点1的表面。在40ns内,第一个位于2位的Cu(II)-Lut已经足够稳定,靠近1位的第二个Cu(II)-Lut开始结合到腔袋中。直到50 ns,两个Cu(II)-Lut配合物结合在位点2和位点1口袋上。上述分析表明,Cu(II)-Lut可以自发从溶液环境中结合到BSA的位点2,接着结合到位点1,形成稳定的BSA-Cu(II)-Lut配合物。
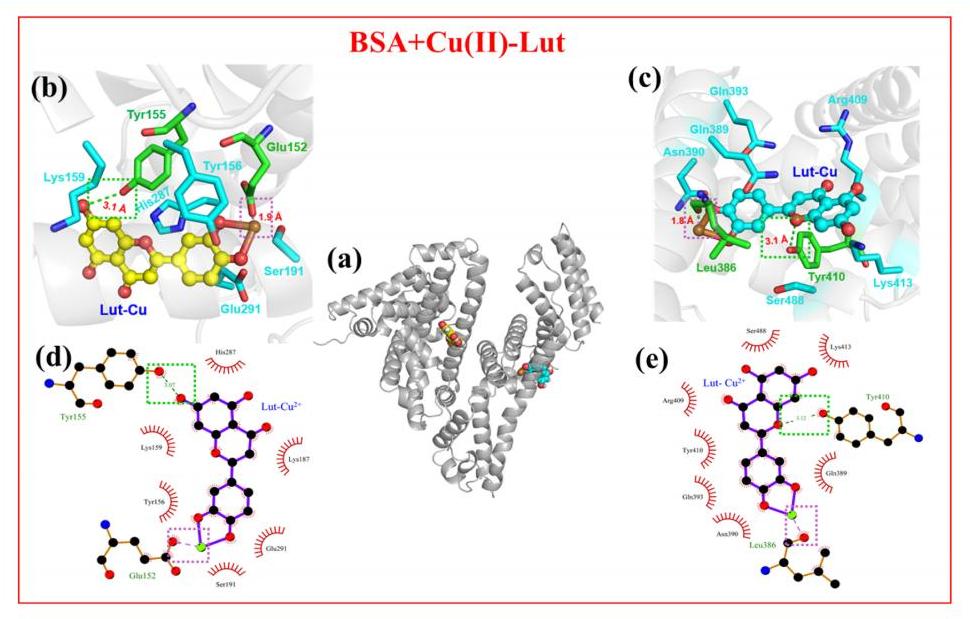
图2 Cu(II)-Lut配合物与BSA的结合模式的二维图三维图。二维图中,红色齿轮表示疏水相互作用,绿色虚线表示氢键相互作用,紫色虚线表示静电相互作用。
Cu(II)-Lut在位点1和位点2的详细结合模式被放大,如图2b-e所示。两个Cu(II)-Lut分子结合在1位(左)和2位(右),相互作用力分析表明,Lut芳香环与周围氨基酸之间的疏水相互作用是稳定Cu(II)-Lut与口袋结合的主要作用力。同时,两个Cu(II)-Lut分子中的Cu(II)与氨基酸氧原子之间存在静电相互作用,进一步增强了Cu(II)-Lut与BSA之间的亲和力。此外,氨基酸基团和Lut在位点1和位点2之间的氢键相互作用也有助于驱动Cu(II)-Lut与BSA结合。相比之下,位点2与Cu(II)-Lut结合的疏水性基团多于位点1,这可能产生更强的驱动力,诱导Cu(II)-Lut优先结合BSA的位点2,其次是位点1。
将单个Lut和Cu(II)对接到BSA上,以与Cu(II)-Lut进行比较。Cu(II)在N端与BSA中Asp-Thr-His三联体结合,配位键的建立是Cu(II)与BSA分子识别的重要驱动力。与Lut相比,两个Cu(II)-Lut分子在BSA的位点1和位点2处的疏水面积更大,可以促进双位点结合,增加Cu(II)-Lut与BSA的结合强度。Cu(II)-Lut与BSA的静电相互作用(Lut与BSA之间没有)可能进一步增强Cu(II)-Lut配合物的这些效应。
结论:
Cu(II)配位显著增强了Lut与BSA的结合,本研究为进一步认识黄酮类化合物作为重要食品成分和抗氧化剂的功能提供了新的视角。