合作单位:Jiangsu University
参考文献:Pei Shan, ChiTang Ho, Lei Zhang, et al. Journal of Agricultural and Food Chemistry, 2022. DOI:10.1021/acs.jafc.2c01796(IF = 6.1)
背景:
酱油是一种口感鲜美的液体调味品,主要原料为大豆/大豆片、小麦粉等。然而,酱油瓶底部容易形成一层土状沉淀物,称为酱油二次沉淀,二次沉淀严重影响酱油的外观质量和市场竞争力。
研究证明,大豆蛋白球蛋白G4的B3亚基占酱油次生沉淀蛋白的76%。由于蛋白酶效率高、安全性好,在发酵过程中对B3亚基进行酶解,被认为是减少酱油二次沉淀形成的一种有潜力的方法。为了筛选可能适合酶解B3亚基的蛋白酶,检索了其氨基酸序列。并认为,能够切割最丰富的几种氨基酸残基的肽键的蛋白酶将有很大的潜力降解B3亚基,以减少酱油二次沉淀的形成。
黑曲霉是公认的安全真菌,含有大量耐酸蛋白酶。其中,脯氨酸内肽酶(APE)是一种能够水解位于多肽链中脯氨酸残基羧基端的肽键的蛋白酶。由于B3亚基含有10个分布较均匀的脯氨酸残基,且酱油发酵主要在酸性条件下(pH 4.5 ~ 5.5)进行,因此B3亚基可能是APE的良好底物。酱油发酵过程中,NaCl浓度约为10 ~ 18% (w/v);因此,APE的耐盐性决定了其在酱油发酵过程中能否降解B3亚基。
方案设计:
本文从黑曲霉中提取制备了APE,并通过实验验证了APE在酱油发酵过程中对B3亚基的降解作用。为进一步阐明APE在酱油发酵过程中催化B3亚基的降解机理,经与魔德科技(www.modekeji.cn)技术团队沟通,拟通过分子动力学方法对其进行研究。
主要结果:
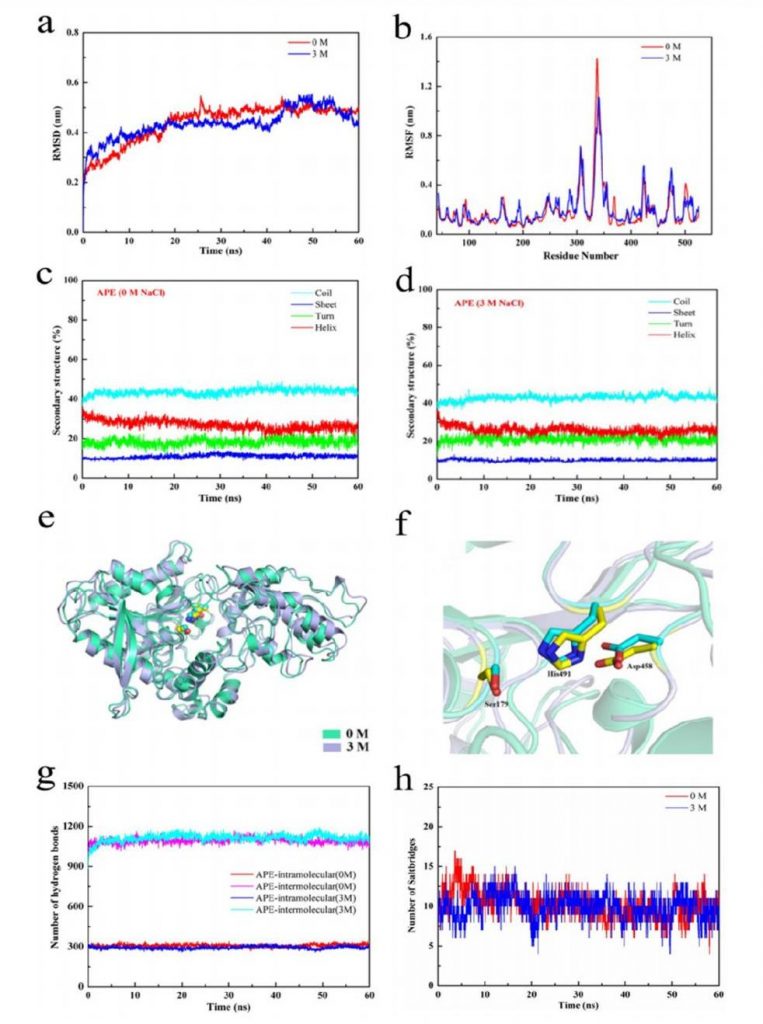
图1 APE在0和3 M NaCl溶液中的分子动力学模拟结果。(a) APE在0和3 M NaCl溶液中的根均方偏差变化;(b) APE在0和3 M NaCl溶液中氨基酸残基的灵活性变化;(c, d) APE在0 M (c) 和 3 M (d) NaCl溶液中二级结构的变化;(e, f) APE在0和3 M NaCl溶液中整体和活性位点空间结构的变化;注释:蓝色表示0M条件下的结构,黄色表示3M条件下的结构。(g) APE在0和3 M NaCl溶液中分子间和分子内氢键数量的变化;(h) APE在0和3 M NaCl溶液中盐桥数量的变化。
骨架原子之间的平均距离可以通过原子位置的均方根偏差(RMSD)来确定。RMSD 值越高,表明蛋白质结构的稳定性越低。均方根涨落(RMSF)表示蛋白质链上每个氨基酸残基的波动。RMSF值越高,意味着蛋白质中氨基酸残基的灵活性越大,表明蛋白质可能发生结构变化。如图 1(a)、(b)所示,在 NaCl 溶液(0 和 3 M)中,两种RMSD值没有显著差异,APE 活性中心氨基酸残基的 RMSF 值随着 NaCl 浓度从0升至3 M有所增加。
如图1(c)、(d),在NaCl溶液(0和3M)中,APE的各二级结构占比基本一致。此外,在60ns时观察到APE及其活性中心在0 M和3 M NaCl溶液中空间结构上无显著差异(图1(e)、(f))。图 1(g)结果表明分子间氢键和分子内氢键都没有受到高盐度的破坏。盐桥是维持蛋白质结构的另一种重要力量,它关系到蛋白酶的功能和活性。如图 1 (h) 所示,APE 在 NaCl 溶液(0 和 3 M)中的盐桥量波动明显,中值为12。
研究表明,内部氨基酸残基的强疏水性有利于蛋白质内部结构的稳定,内部疏水性氨基酸残基摩尔百分比较高的蛋白酶(天冬氨肽酶和碱性蛋白酶)在 3 M NaCl 溶液中具有较高的稳定性和活性。APE 的内部疏水氨基酸残基摩尔百分比为 43%,该值接近天冬氨肽酶(43%)和碱性蛋白酶(46%)的相应值。因此,有理由推测内部氨基酸残基的强疏水性是APE在3 M NaCl 溶液中保持稳定的重要原因。基于实验和计算对APE的分析,可以合理推断在3天内,高盐度不能改变APE的空间结构,特别是其活性中心。但随着三天后内部疏水氨基酸暴露,它们的空间结构稳定性和活性降低。
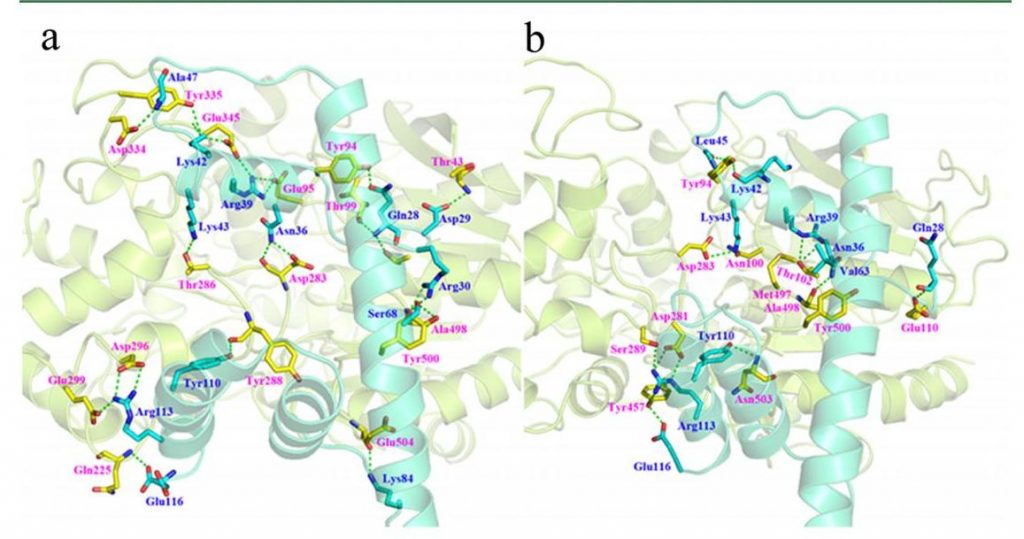
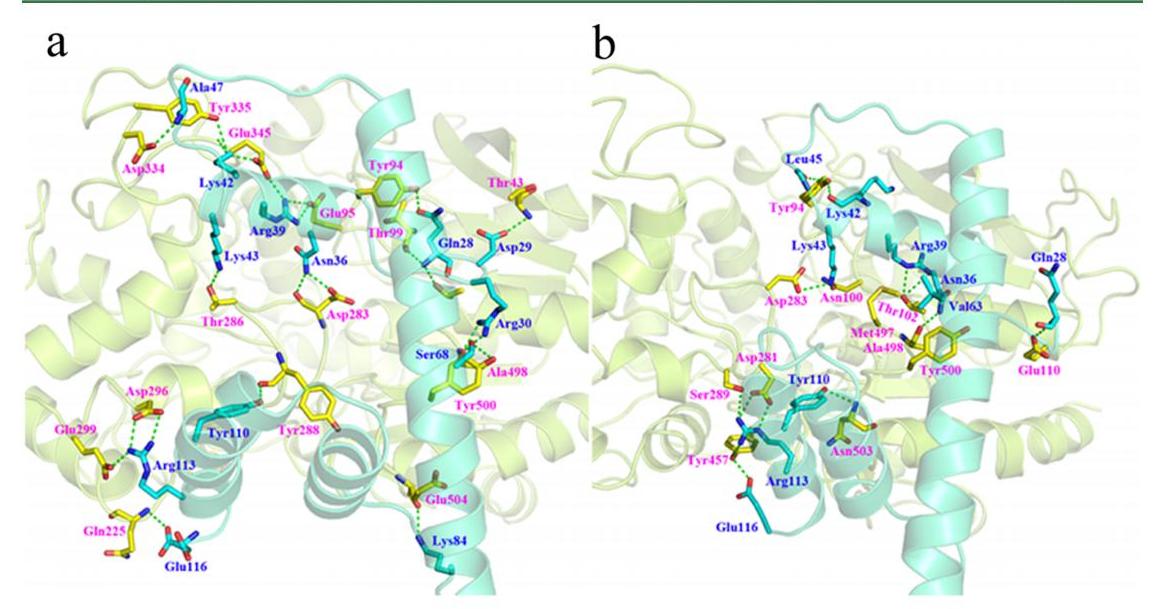
图2 APE和B3亚基的分子对接。(a, b) 在0 M (a)和3 M (b) NaCl溶液中APE与B3亚基结合模式。注释:蓝色和紫色字母分别代表B3亚基和APE中的氨基酸,绿色虚线表示氢键相互作用。
如图2(a)、(b)所示,高盐度对APE与B3亚基反应时构象的影响可以忽略不计。然而,高盐度对B3亚基的构象以及形成APE与B3亚基之间氢键的氨基酸残基有显著影响。如图2(b),在3M NaCl溶液中B3亚基左侧的两个平行α-螺旋比在0 M NaCl溶液中更接近,说明B3亚基在3M NaCl溶液中的刚性比在0 M NaCl溶液中更强。在0 M NaCl溶液中,APE的17个和B3亚基的12个氨基酸残基参与了氢键的形成,而在3 M NaCl溶液中,APE和B3亚基参与氢键形成的氨基酸残基只有12个和9个。上述结果表明,高盐度改变了B3亚基的构象,在一定程度上降低了APE与B3亚基之间的亲和力。
结论:
综合实验测试、MD以及APE与B3亚基的分子对接分析,可以得出,高盐度对APE空间结构稳定性和活性的影响可以忽略不计,但随着时间的推移,APE的稳定性和活性会逐渐丧失。然而,高盐度使B3亚基更加刚性,导致APE与B3亚基的亲和力降低,APE对B3亚基的催化活性降低。这也解释了为什么APE在酱油发酵过程中不能完全降解B3亚基。