降脂、调节血糖和体重还可以这样
合作单位:Chongqing Medical University
参考文献:Zhao Y, Li Y, Wang F, et al. CES1-Triggered Liver-Specific Cargo Release of CRISPR/ Cas9 Elements by Cationic Triadic Copolymeric Nanoparticles Targeting Gene Editing of PCSK9 for Hyperlipidemia Amelioration. Advanced Science, 2023, 10(19): 2300502. doi: 10.1002/advs.202300502. (IF=14.3)
背景:
基因组编辑系统正在成为生物医学研究、基因药物开发甚至基因治疗的基础。在所有的基因编辑工具中,CRISPR/ Cas9因其简单、灵活和有望一次性治愈遗传性疾病,在疾病治疗策略的研究中显示出巨大的优势。一些基于CRISPR/ cas9的临床试验也正在进行或即将开始,例如用于癌症治疗的嵌合抗原受体t细胞免疫疗法和靶向肝脏的基因编辑疗法用于降脂治疗。然而,如何将CRISPR/ Cas9组分安全有效地递送和释放到靶器官、细胞和细胞核中仍然是基因组编辑介导的疾病治疗的主要挑战,这将直接影响该系统的成功和治疗应用。
脂质体、聚合物和无机纳米颗粒在CRISPR/ Cas9递送中显示出优势。相比之下,脂质体和无机纳米颗粒、聚合物表现出优异的模块化和易于功能化,可以很容易地从合成单体或预制聚合物中制备,这可以在制备过程中精确控制纳米颗粒的各种性质。聚合物也具有不同的药物递送能力,聚合物纳米颗粒可以递送不同的药物,包括不同分子量的化合物,如小分子、生物大分子和蛋白质,可以满足不同的CRISPR/Cas9共递送形式(Cas9- mRNA /sgRNA、质粒和Cas9/sgRNA核糖核蛋白)的需求。因此,它们被认为是CRISPR/Cas9的优秀传递平台。此外,对影响基因传递和编辑过程的CRISPR/Cas9聚合物的研究也引起了广泛的兴趣,包括表面电荷的类型、聚乙二醇化程度、CRISPR/Cas9的类型以及靶组织的位置。
阳离子共聚物主导CRISPR/ Cas9传递,因为CRISPR/ Cas9组分的高负载潜力和通过静电相互作用的细胞吸收效率,随着RAFT聚合的出现。已经开发了几种用于siRNA递送的阳离子共聚物载体。然而,与短sgRNA共递送更大的Cas9-mRNA分子或Cas9蛋白仍然具有挑战性。更重要的是,阳离子部分由于干扰细胞膜完整性而容易引起细胞毒性。到目前为止,几乎没有阳离子聚合物纳米材料被食品和药物管理局批准用于临床。设计和合成无害的阳离子共聚物传递体系来解决这些问题是必要的。
二甲双胍是2型糖尿病的一线药物治疗,这种阳离子药物已经显示出疗效和良好的安全性。最近的报道表明,胍基功能化的聚合物可以通过Gu+/ PO34-静电和氢键相互作用很容易地粘附在核酸上。因此,二甲双胍可能是设计具有内在降糖活性的安全阳离子基因载体的理想聚合物单体。然而,这些相互作用增强了核酸和胍基团之间的稳定性,通常导致细胞内释放不良,从而导致效率低下。在保持稳定性的同时解决释放问题也是研究的一个理想目标。
羧酸酯酶(CES)是将羧酸酯酶水解成相应的醇和羧酸的酯酶家族成员。羧酸酯酶1 (CES1)和羧酸酯酶2 (CES2)是参与外源代谢的两种主要酶。尽管CES1和CES2具有一定的序列同源性,但它们表现出不同的分布和底物特异性。例如,CES1在肝脏中大量表达,而CES2主要在小肠和结肠中表达。此外,CES1优先代谢含有小醇基和大酰基的酯键。与CES1相反,CES2优先水解含有较大醇基和较小酰基的酯。因此,假设在阳离子共聚物中加入一个简单的CES1活性丙酯单体可以实现多种效果。首先,在阳离子共聚物中加入疏水力,使其能够有效地封装核酸。其次,减少一些正电荷可以进一步降低潜在的细胞毒性。第三,这种结构有助于阳离子共聚物选择性地从肝细胞中释放RNA。第四,经CES1活化后,丙酯水解成相应的醇和羧酸,并带负电荷。这种负电荷可以竞争性地干扰双胍类化合物与核酸之间的静电和氢键相互作用,促进核酸的进一步释放。
本文首次设计并制备了肝脏CES活化的二甲基双胍三元共聚物(mPEG-b-P(Met/n-PMA))。采用RAFT聚合技术将胍和丙酯单体共聚到甲氧基聚乙二醇修饰的4-氰基-4-(苯基硫代甲酰基硫)戊酸(mPEG-CPADN)上。mPEG是增加亲水性以降低阳离子共聚物毒性的另一理想选择,因为它通常用于修饰阳离子共聚物以减少蛋白质吸附,提高核酸转染效率。由梳状聚合物组成的聚乙二醇没有表现出任何明显的毒性作用。如图1所示,选择肝(PCSK9作为治疗靶点,以证明共聚物作为Cas9-mRNA/ sgPCSK9的纳米载体,可降低血浆低密度脂蛋白-胆固醇(LDL-C)水平,改善高脂血症。有趣的是,除了降脂作用外,还发现了这种策略在调节血糖和体重方面的双重作用。
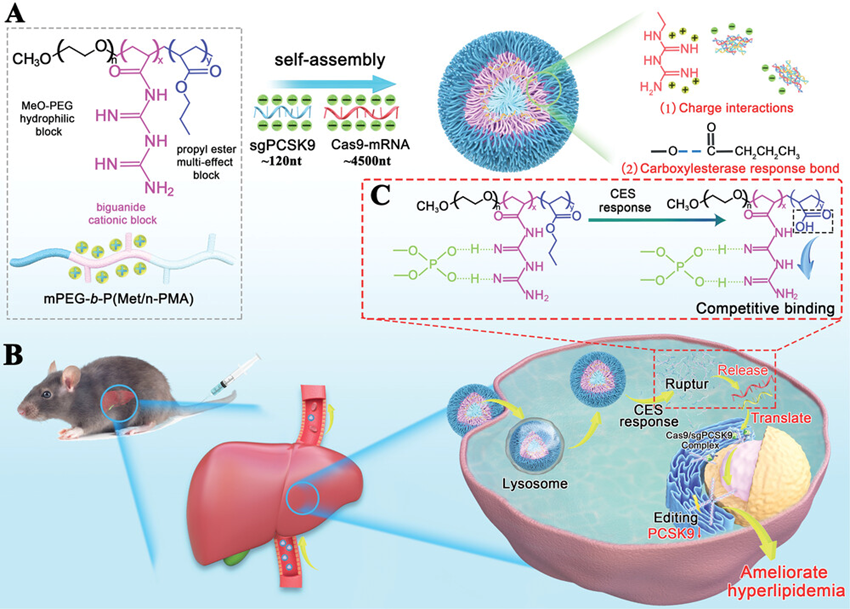
图1使用mPEG-b-P(Met/n-PMA)递送Cas9-mRNA/sgPCSK9改善高脂血症的示意图
方案设计:
为了研究RNA的负载能力。通过与魔德科技技术团队沟通,拟采用分子对接和分子动力学模拟方法研究mPEG-b-P(Met/n-PMA)与RNA (mPEG-b-P(Met/n-PMA)/ RNA)之间的自组装机制和程度。
主要结果:
大分子设计与合成
本研究首先合成了mPEG-CPADN链转移试剂(化合物5)(图2A)。随后,N-(2-(3-氨基甲酰胍)乙基)甲基丙烯酰胺(化合物3)和N-甲基丙烯酸丙酯(化合物6)单体以mPEG-CPADN和偶氮二异丁腈(AIBN)为宏观引发剂,进行RAFT共聚得到mPEG-b-P(Met/ N- PMA)。合成过程在实验部分描述,如图2A所示。化合物结构通过H- NMR、C-NMR和红外光谱进行确认(图2B)。进一步的紫外光谱分析和凝胶渗透色谱分析表明,mPEG-b-P(Met/n-PMA)的分子量为≈10,000 MW,在305 nm处有紫外吸收峰。
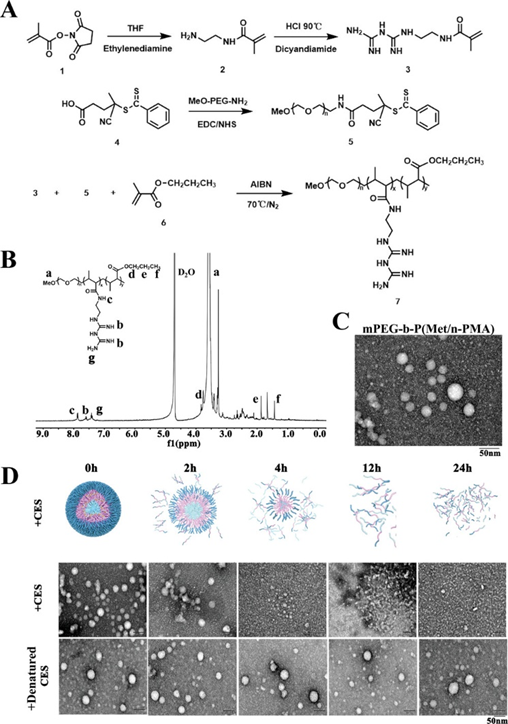
图2 mPEG-b-P(Met/n-PMA)的形成、表征和分解
RNA负载能力的分子动力学模拟
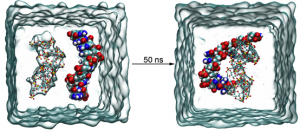
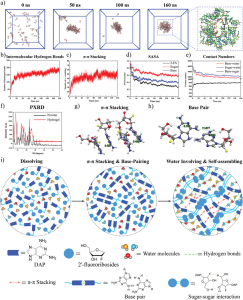
为了深入了解mPEG-b-P(Met/n-PMA)与RNA (mPEG-b-P(Met/n-PMA)/ RNA)之间的自组装机制和程度,采用分子动力学(MD)模拟方法模拟了mPEG-b-P(Met/n-PMA)/RNA的形成过程。在典型的模拟过程中,构建了能量优化的RNA和mPEG-b-P(Met/n-PMA) 3D模型。然后,将8个mPEG-b-P(Met/n-PMA)分子和1个RNA分子溶剂化到15 cm × 15 cm × 15 cm的立方水盒中,结果表明,经过100 ns后,所有分子都自组装成球形颗粒(图3A)。结果表明,mPEG-b-P(Met/n-PMA)中的氧原子和氮原子与RNA形成氢键,而亚甲基则与RNA形成层合。图3B显示了RNA和mPEG-b-P(Met/n-PMA)的均方根偏差(RMSD)的变化。RNA的RMSD在整个模拟过程中略有波动,说明RNA分子在整个模拟过程中是相对稳定的。mPEG-b-P(Met/n-PMA)的RMSD在模拟开始时发生显著变化并趋于稳定,表明mPEG-b-P(Met/n-PMA)与RNA可以组装形成稳定的纳米颗粒。接下来,使用GROMACS能量模块探索mPEG-b-P(Met/n-PMA)和RNA之间的能量大小(图3C)。这一结果表明,随着配合物的持续聚集,静电(源于氢键相互作用)和范德华能得到增强。如图3D所示,mPEG-b-P(Met/n-PMA)与RNA之间的氢键数增加,而RNA与水之间的氢键数减少,说明氢键是mPEG-b-P(Met/n-PMA)与RNA聚集的主要驱动力。在PEG-PMet与RNA的自组装过程中,暴露在溶剂中的面积逐渐减小;因此,溶剂可及表面积(SASA)可用于评价球形颗粒的自组装紧密性。另外,PEG-PMet/RNA复合物的SASA值下降并趋于稳定,说明PEG-PMet与RNA聚集自组装成稳定的胶束。此外,SASA在模拟后期保持稳定,表明簇结构没有因溶剂的影响而解离。
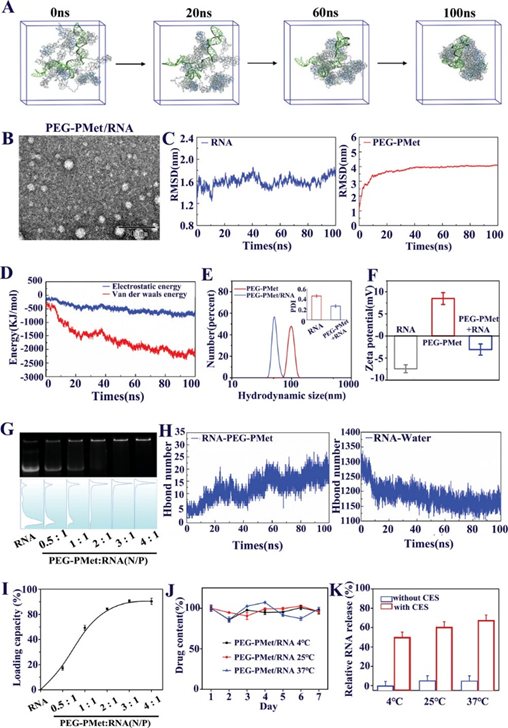
图3 mPEG-b-P(Met/n-PMA)的RNA装载和释放能力
mPEG-b-P(Met/n-PMA)调节体重增加和缓解胰岛素抵抗
在体内评估mPEG-b-P(Met/nPMA)的有效性和安全性时,发现mPEG-b-P(Met/n-PMA)对体重控制的作用过大。与Lipo3000和二甲双胍相比,mPEG-b-P(Met/n-PMA)减轻了高脂饮食(HFD)诱导的体重增加。因此,监测了mPEG-b-P(Met/n-PMA)对血糖水平的影响。首先,在给药前进行葡萄糖耐量试验(GTT)和胰岛素耐量试验(ITT),并与正常饮食(NCD)进行比较。HFD、mPEG-b-P(Met/nPMA)和Lipo3000的GTT和ITT均有改善,提示小鼠出现轻度葡萄糖和胰岛素抵抗。给药14 d后,与Lipo3000和HFD相比,mPEG-b-P(Met/n-PMA)的GTT和ITT降低,表明mPEG-b-P(Met/n-PMA)改善了葡萄糖和胰岛素抵抗。
结论:
通过设计、合成和表征新型mPEG-b-P(Met/n-PMA),该文发现mPEG-b-P(Met/n-PMA)可以通过静电和范德华相互作用将核酸形成稳定的纳米胶束,并且mPEG-b-P(Met/n-PMA)可以被肝脏中的CES选择性激活和分解。这些纳米胶束在体内和体外都能将核酸输送到肝细胞。这种递送策略实现了PCSK9的高效基因组编辑和血清LDLC的下调。值得注意的是,除了降脂作用外,该策略还具有调节血糖和体重的双重作用。然而,mPEG-b-P(Met/n-PMA)调节血糖和体重的机制、药代动力学和药效学尚不清楚。综上所述,这些数据证明进一步探索核酸载体二甲双胍是有必要的。此外,mPEG-b-P(Met/n-PMA)介导的PCSK9基因编辑具有改善高脂血症的潜力。