合作单位:Chinese Academy of Sciences
参考文献:Liu W, Lu Z, Yuan S, et al. Identification and mechanistic analysis of a bifunctional enzyme involved in the C-N and N-N bond formation. Biochemical and Biophysical Research Communications, 2022, 635: 154-160. DOI: 10.1016/j.bbrc.2022.10.039 (IF=3.1)
背景:
含有N-N键的化合物是一类相对较少但非常重要的具有生物活性的天然产物,包括腙、肼、酰基腙和一系列杂环支架等化合物。目前,含有N-N键的化合物已广泛应用于许多药物和生物活性分子中,发挥着抗炎、抗肿瘤、抗菌、抗氧化等多种重要的生物活性。同时,含N-N键的化合物因其高效低毒的特点,也被广泛应用于除草剂、杀菌剂、杀虫剂等农药领域。这些自然产生的次生代谢物对生物医学领域做出了重大贡献,有助于发现新的化学合成方法和生物相互作用途径。
作为一种合成策略,N-N键的形成已成为从现成材料构建高价值杂环的重要步骤。现有的研究成果已经能够通过多种化学合成构建分子内或分子间N-N键,但仍然存在一些问题。例如,在合成三聚氰胺(一种N-N键合化合物)时,底物尿素需要在0.5-7MPa、380-400°C的高温高压下反应,存在安全隐患。因此,仍然需要开发绿色的N-N键生物合成途径。
2021年,研究人员将自然界中N-N与生物合成的机制分为三种类型:配比反应、重排反应和自由基重组反应。除了由氮瞬时自由基诱导的N-N键重组反应外,目前已报道的N-N键合酶有十多种,可以参与到配比或重排反应中。配比反应是高氧化态的元素与低氧化态的相同元素反应,形成接近中间氧化态的该元素的产物的过程。该反应通过改善其中一个氮原子的亲电性将氨基转化为更高的氧化态,从而促进另一个氨基的亲核攻击,以催化两个氮原子之间合成反应的开始。该合成反应包含一系列N-N键合成酶,如KtzT、MatF、肼合成酶、细胞色素P460 (CYP460)和CYP450nor,它们利用羟基氨基酸作为高氧化态氮供体,CreM依赖于天冬氨酸/琥珀酸硝基(ANS)提供的亚硝酸盐来合成N-N键。类似的途径也存在于N-N结合的化合物中,如l -丙氨酸、fragin、fosfazinomycin和kinamycin。参与重排反应的NeN键合成酶都含有一个保守的杯形结构域,并利用金属(铁、铜、钴、镍、锌或锰等)作为辅因子。Cupin蛋白含有一个保守的b桶折叠和两个序列保守基序:一个是G(X)5HXH(X)3-4E(X)6G,另一个是G(X)5PXG(X)2H-(X)3N。重排反应包括在556 -p1生物合成基因簇中负责N-N键合成的Spb40、在吡唑霉素生物合成基因簇中与Spb40同源的PyrN、链脲佐菌素生物合成中的金属酶SznF以及催化天然产物gramibactin合成的GrbD。但重排反应的确切机制仍未得到解决。
近几十年来,合成生物学发展迅速,在N-N键的生物合成方面取得了很大进展。然而,目前仅报道了13种N-N键合成的关键酶,并且大多数已知的N-N键合酶体外活性低,底物范围窄。关于它们的酶性质和催化机制的关键信息也尚不清楚,这阻碍了对N-N键生物合成的更深入了解。因此,该研究通过对已知N-N键合酶的基因挖掘、重组蛋白的表达以及对N-N键合成能力的验证,鉴定出具有N-N键合成活性的未知蛋白PAI2,探索PAI2的酶学性质和底物范围,并解析该N-N键合成酶的催化机制,扩大了N-N键合酶家族,为后续的N-N键生物合成研究奠定基础。
方案设计:
为了研究KtzT和PAI2催化能力的差异及PAI2的结合位点。通过与魔德科技技术团队沟通,拟通过序列比对、同源模建、分子对接和分子动力学的方法探索构建KtzT和PAI2蛋白结构,并通过靶向诱导突变PAI2的关键氨基酸得到可能的结合位点。
主要结果:
KtzT和PAI2催化能力差异分析
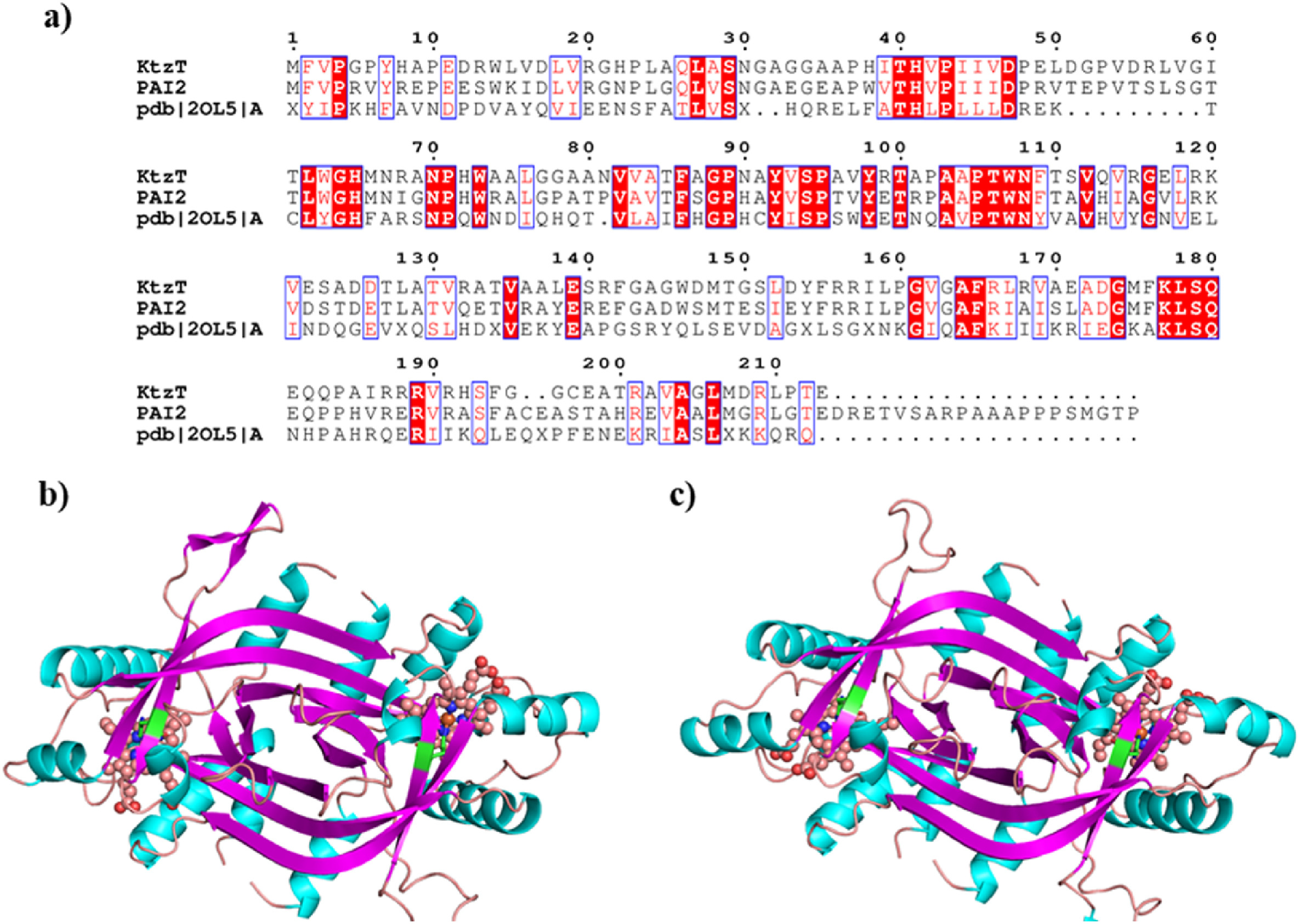
基于KtzT和PAI2蛋白的序列,通过NCBI数据库进行同源性筛选,发现了一种与两种蛋白具有高度同源性的蛋白(PDB代码2OL5),并以此为模板。首先,使用CLUSTALW程序对KtzT和PAI2蛋白与2OL5蛋白进行测序匹配,序列同一性分别为31.21%和31.63%。随后,使用SWISS-MODEL程序对KtzT和PAI2蛋白的3D结构进行建模,以获得合理的3D结构模型(图1)。结合Ramachandran图和Verify 3D评分表明,KtzT和PAI2蛋白的构建结构高度可靠,可用作后续研究的模板。
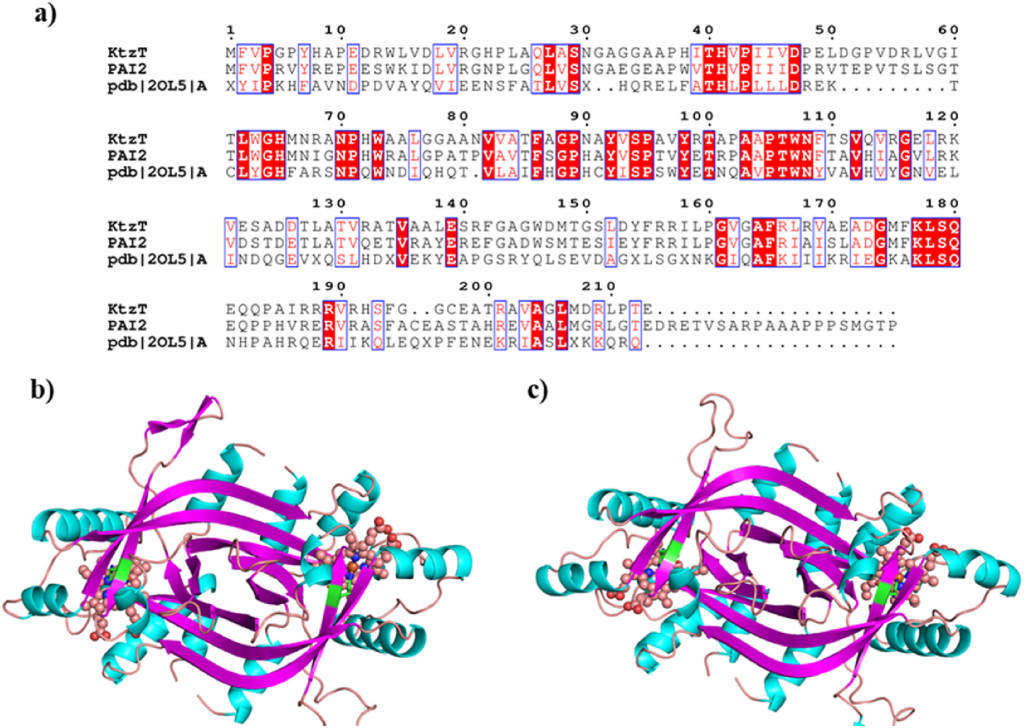
图1. KtzT 和 PAI2 蛋白质的结构建模。(a) KtzT和PAI2蛋白与2OL5蛋白的序列比对结果;(b)KtzT蛋白模型的三维结构;(c)PAI2蛋白模型的三维结构。粉红色的球棒模型代表蛋白质中的血红素。
从上图可以看出,KtzT和PAI2的催化能力与PAI2的催化能力略有不同。文献研究表明,KtzT和PAI2蛋白的催化活性主要位于血红素上方的空腔内,反应物的活性原子主要是末端N与氨基反应,其间末端NH基团靠近血红素的Fe原子并被激活。此外,在 KtzT 和 PAI2 蛋白中,His65 是这类酶活性的关键位点,因为 His 环上的 N 原子与血红蛋白上的 Fe 形成配位,稳定了血红蛋白在蛋白质中的位置,用于其与底物之间的催化反应。为了进一步分析KtzT和PAI2在底物结合方面的差异,以剖析KtzT和PAI2不同催化能力的原因,该研究对化合物1进行了底物分子对接。根据Autodock软件的预测,KtzT和PAI2的结合能分别为-4.838 kcal/mol和-4.848 kcal/mol,差异无统计学意义。因此,为了解释不同底物和蛋白质催化活性的差异,分析了对接后底物和蛋白质的相互作用模式。
在KtzT中,化合物1的羧基与Tyr98、Ser179和Gln182形成氢键相互作用,而末端-NH-和-OH不与周围的氨基酸形成氢键相互作用,而是位于由4个氨基酸残基和血红素形成的疏水腔中,稳定了化合物在活性位点的构象; 在PAI2中,化合物 1 与周围氨基酸形成强疏水相互作用,而末端–OH 基团与 Lys177 形成氢键相互作用。末端氢键相互作用可以稳定化合物在活性位点的构象,使催化反应更容易发生。结合模式分析结果表明,不同底物与蛋白质之间的相互作用存在较大差异,这可能是蛋白质对底物催化活性存在差异的原因之一。
为了进一步研究血红蛋白附近不同底物的催化构象差异,分析了化合物1与血红蛋白结合构象的结果。具体而言,两种蛋白质的结合构象基本相似,末端N原子位于血红蛋白Fe原子上方,两者均具有合理的催化构象,有利于催化反应。构象分析后,分析了化合物1的关键反应基团与血红蛋白分子中Fe离子之间的距离,以可视化构象差异对催化反应的影响,KtzT中N原子与Fe原子之间的距离为4.3 Å,PAI2中Fe原子之间的距离为4.4 Å。不同的蛋白质结合构象会影响到活性位点的距离,并可能影响不同蛋白质与底物反应的难易程度。
PAI2的关键底物结合位点
已有研究报道,KtzT可能通过血红素使N-O键极化,从而促进NH3的亲核攻击,从而起到N-N键合成器的作用。基于此,该工作推测,被血红素极化的羟胺基团可能与反应中心的氨基发生脱水缩合。如果这一假设成立,在底物结构与天然底物相似的情况下,用C原子、KtzT和PAI2等其他原子取代羟基上的N原子,也可能催化C原子与氨基的缩合,从而形成新的化合物。因此,为了验证这一假设,该研究选择结构与天然底物相似的2-氨基-5-羟基戊酸(化合物4)、2-氨基- 6-羟基己酸(化合物5)和2-氨基-7-羟基庚酸(化合物6)作为底物,测试KtzT和PAI2是否能以类似的机制催化C-N键等其他键的形成。
PAI2催化了化合物4、5和6的分子内环化反应,验证了PAI2是否具有催化C-N键形成的能力。将所得产物与预期产物脯氨酸(Pro)的Fmoc衍生物的液体质量信息进行比较,观察到产物的保留时间和质谱(m/z 338)与Pro相匹配。反应结果表明,与KtzT结果一样,只有化合物4能够生成PAI2催化的新物质,证明PAI2还具有催化化合物4中烃基团与氨基缩合形成五元环的能力(图2)。
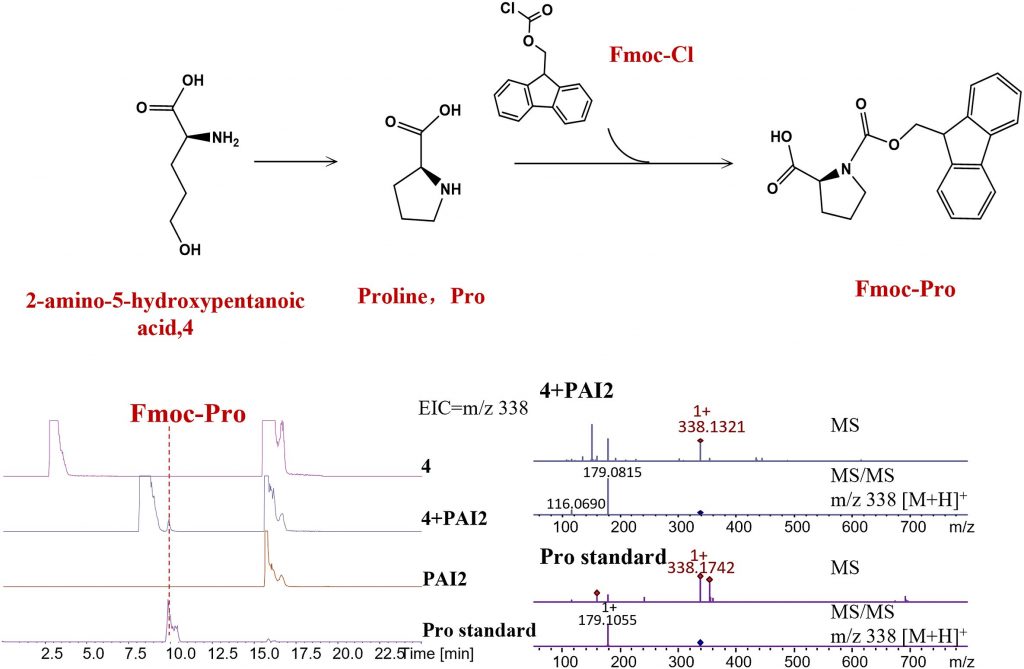
图2. 体外PAI2催化的Pro的合成(A)LC-MS 分析中 Pro. EIC(m/z 338,对应 Fmoc-Pro)的生物合成和衍生化(B)
然而,在化合物5和6与PAI2的反应中,未能通过LC-MS检测目标产物。因此,对化合物 5 进行了构象分析,在 PAI2 中,化合物 5 与周围的 Ala103、Ala104、Pro105、Thr106 和 Glu181 之间形成了强疏水相互作用,其中–NH2在化合物上与Tyr98形成氢键相互作用,而末端-OH基团与Lys177形成氢键相互作用。与化合物3一样,化合物5的烷基链相对较长,导致末端基团向外发生显著变形,使反应性基团远离血红蛋白分子,化合物5中N原子与铁原子之间的距离为6.1 Å,不利于化合物5的催化。
基于分子对接结果,获得了几个可能的底物结合位点,并对这些位点进行了突变,获得了几个突变株。通过检验不同突变株对不同底物的活性趋势是否与野生型(WT)相同,验证了该位点与底物结合的相关性。基于分子对接结果,通过靶向诱变获得相应的突变株V93A、A103G、A104G、T106A、S179A、E181A、Q182A。对所得突变体与6种不同链长的底物化合物1、2、3、4、5和6进行催化反应,并与WT进行比较。反应结果如表2所示。突变菌株A104G在与化合物1的反应中表现出与WT不同的活性趋势。从PAI2与底物分子对接的结果中可以看出,Ala104通过疏水相互作用与底物结合,在与化合物1的反应中起关键作用。相比之下,其他位点的突变菌株在不同底物下表现出与WT相同的活性趋势,表明PAI2与底物的结合可能通过多个位点起作用,仅突变单个位点不会对底物的结合产生决定性影响。
结论:
在目前的研究阶段,与KtzT同源的PAI2首次被表征。与KtzT相比,PAI2对L-OH-Orn具有更好的活性,并且具有不同的酶学性质,可应用于不同的生物催化领域。同时,该研究尝试利用PAI2构建环状α-肼酸,并成功获得了五元环Aza-Pro。还发现了PAI2催化Pro中C-N键形成的能力。 此外,通过蛋白质结构分析鉴定了PAI2的底物结合位点,初步阐明了PAI2的催化机理,为今后N-N键合酶的催化机理和分子作用机理分析提供了参考。