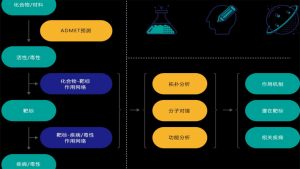
什么是蛋白质同源模建
在分子水平上看,基因、蛋白质都是在不断进化的过程中的。基因复制和趋同化导致了同源蛋白组系的产生,起源相同的蛋白质叫同源蛋白,同源蛋白可能来自共同祖先。通过比较同源蛋白质氨基酸序列的差异可以研究不同物种间的亲源关系和进化关系。人们通过对比空间结构相似的蛋白质发现,蛋白质的三维结构比蛋白质的一级结构更加保守,而后者又比DNA序列更为保守。因此,人们可能根据己知蛋白质三维结构推测得到未知结构的同源蛋白质的初步结构。这正是同源模建的原理。同源模建就是指根据已知结构的蛋白推测未知结构的同源蛋白。
同源模建的方法、步骤
(1) 同源蛋白的搜索
首先,找出与目标蛋白序列同源且结构已知的模板蛋白,这是同源模建需要的材料。FASTA和BLAST是常用的同源蛋白搜索程序。
(2)序列比对
通过目标蛋白与模板蛋白的序列比对可确定出序列的保守区域。序列比对依靠于各种得分矩阵,常用的得分矩阵有同源性矩阵(identity matrix)、突变矩阵(mutation matrix)、密码子矩阵(codon substitution matrix)等。
(3)模型搭建
模型搭建的主要工作就是对保守区和柔性的序列区进行坐标赋值。对目标蛋白和模板蛋白进行序列比对后,就得出保守区氨基酸残基的坐标。若两者的序列完全相同,则将模板蛋白的残基坐标直接赋值给目标蛋白的残基;若两者的残基不同,则把模板蛋白主链坐标赋值给目标蛋白,而侧链则尽量保持结构模式的相似性;保守区以外的区域则为非保守区,非保守区模型搭建主要有两种方法:一为数据库搜索法;二为随机产生法。目标蛋非保守区的建立基于统计法与随机搜索法,会引入一定的误差。
(4)模型优化
模型产生后需对其分子结构做进一步优化,以消除原子间的重叠以及不合理的构象,尤其是保守区的构象。优化的方法主要为分子力学法与分子动力学法。
(5)模型评价
模型评价的指标主要包括立体化学和能量两个方面。评价模型中,PROCHECK程序可用于立体化学评价,而 PROSA程序可用于能量评价。
基于多模板的同源模建
Step 1:
寻找合适的模版
利用结构聚类的方法,找到4bdm的家族
Step 2 :
多模板的初步序列3d比对
Step 3 :
序列比对2d
Step 4 :
基于多模板建立模型
Step 5 :
评价产生的模型